二甲双胍作为一种广泛应用于治疗2型糖尿病的药物,近年来因其潜在的延缓衰老和神经保护作用而受到科学界的极大关注。研究发现,二甲双胍不仅可以调节能量代谢,还能通过改变线粒体功能,促进人类寡突胶质细胞的成熟和功能提升,从而为多发性硬化症(MS)等中枢神经系统疾病的治疗提供新思路。本文将详细解析二甲双胍对线粒体相关代谢的影响机制,以及其在增强人类寡突胶质细胞功能方面的重要作用,结合最新的科研成果,探讨其在神经保护中的应用前景。寡突胶质细胞是中枢神经系统中主要负责髓鞘形成的细胞类型,通过包裹轴突形成髓鞘,它们不仅加速神经信号传导速度,还为神经元提供代谢支持。多发性硬化症是一种以髓鞘脱失为特征的自身免疫疾病,导致神经传导功能障碍和神经退行性变化。髓鞘的修复依赖于寡突胶质前体细胞(OPCs)向成熟寡突胶质细胞的分化,但随着年龄的增长和疾病进展,这一过程的效率逐渐降低。
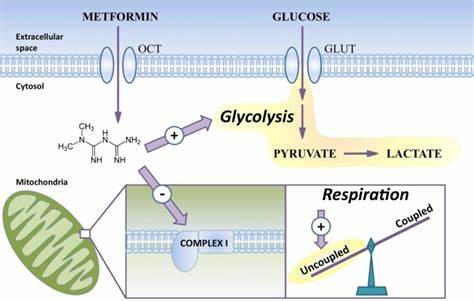
近年来研究表明,二甲双胍能够穿过血脑屏障,并直接作用于中枢神经系统,促进老年或受损OPCs的功能恢复,增强其分化能力,实现更有效的再髓鞘形成。二甲双胍的分子机制主要通过抑制线粒体电子传递链中的复合物I,调节细胞能量平衡,进而激活AMP-活化蛋白激酶(AMPK)信号通路。AMPK作为细胞的能量感应器,能够促进细胞内的代谢调节,增加能量生成和细胞应激反应能力。这种能量代谢的调整对于细胞的发育、分化和功能维持至关重要。在最新的研究中,使用人类胚胎干细胞(hESC)或诱导多能干细胞(iPSC)衍生的寡突胶质前体细胞,通过单细胞RNA测序对比发现,二甲双胍能显著提升这些细胞的分化状态,使它们在基因表达层面更接近成熟的人类寡突胶质细胞。此外,二甲双胍处理还带来了线粒体形态和功能上的显著变化。
电子显微镜观察显示,二甲双胍促进了寡突胶质细胞以及神经轴突中线粒体面积的增加,这可能反映出线粒体数量或大小的提升,有助于增强细胞的代谢活力和能量供应。基因表达分析进一步证实,二甲双胍处理的寡突胶质细胞中与线粒体电子传递链相关的核编码基因如NDUFA11和COX8A表达上调。这两个基因分别参与电子传递链复合体I和复合体IV的组装与功能维护,提升了线粒体的呼吸效率和ATP产量。有趣的是,二甲双胍还促进了翻译起始因子EIF1的表达,这一因子的增加可能促进了细胞内与线粒体功能相关的mRNA的高效翻译,从而支持细胞能量代谢的进一步提升。不仅如此,寡突胶质细胞在接受二甲双胍治疗后,其髓鞘蛋白的合成明显增强,形成更厚实的髓鞘层,促进了轴突的功能修复和神经信号的快速传导。在体内脊髓移植的小鼠模型中,二甲双胍处理组的髓鞘形成量显著增加,髓鞘厚度得到改善,这一结果也印证了其临床治疗神经系统疾病的潜力。
值得关注的是,二甲双胍的作用并非仅限于寡突胶质细胞本身。在动物模型和人类多发性硬化症患者的脑组织中,除了寡突胶质细胞外,神经元、星形胶质细胞和小胶质细胞等多种细胞类型线粒体相关基因表达同样发生改变,揭示了二甲双胍对中枢神经系统不同细胞类型线粒体代谢的广泛影响。此种多细胞类型的代谢调控有助于建立一个有利于神经保护和修复的微环境,促进整体神经组织的健康和功能恢复。多发性硬化症患者脑组织中也观察到服用二甲双胍的患者,寡突胶质细胞中EIF1转录水平明显升高,显示临床用药的确能在体内激活类似的线粒体功能提升机制。当前,二甲双胍正在多个临床试验中被测试用于多发性硬化症及其他神经退行性疾病的治疗,期望验证其通过改善线粒体代谢和促进寡突胶质细胞功能的机制,是否真正转化为临床的神经保护效应。除了其直接对髓鞘修复的促进,二甲双胍还可能通过降低血糖、调节血压和增强脑血流等全身代谢效应间接支持神经系统健康。
其线粒体靶向的双重作用模式,既直接调整神经细胞的能量供给,又改善整体代谢环境,为多种神经疾病的综合治疗提供了可能性。对于神经科学研究领域,二甲双胍带来的这一新发现为理解寡突胶质细胞的发育及功能调控提供了重要视角。通过修改线粒体形态及功能,药物能够促进细胞分化和髓鞘合成,突破了传统对寡突胶质细胞分化迟缓的限制。未来,结合先进的干细胞技术和高通量单细胞测序方法,将进一步揭示二甲双胍及其他代谢调节剂如何作用于不同阶段和类型的神经胶质细胞,推动精准医疗的发展。二甲双胍作为一种在临床中使用广泛、安全性良好的小分子药物,其在神经保护、再生中的新应用前景十分广阔。结合其对线粒体相关代谢的调控,未来有望为多发性硬化症等髓鞘疾病带来突破性的治疗方法,改善患者的生活质量。
总结而言,二甲双胍通过调节细胞内线粒体功能,激活AMPK信号通路,提升人类寡突胶质细胞的代谢活力与分化能力,增强髓鞘生成,从而为神经退行性疾病尤其是多发性硬化症的治疗提供了新的策略。基于其良好的安全性和独特的作用机制,二甲双胍在未来的神经疾病临床应用中具备广阔前景,携手干细胞生物学和代谢医学,有望开启神经修复的新纪元。 。