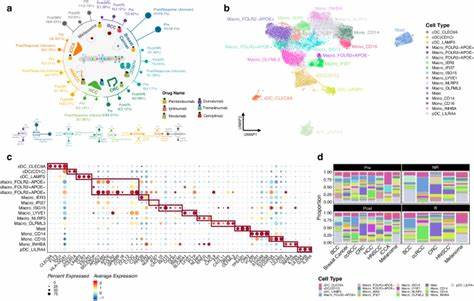
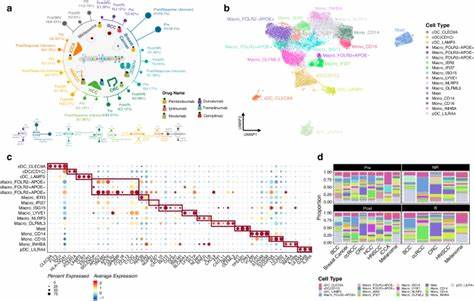
肿瘤微环境(Tumor Microenvironment,简称TME)作为肿瘤发生、发展及治疗反应的关键组成部分,一直是癌症研究关注的焦点。肿瘤微环境不仅由癌细胞本身组成,还包括数量众多的免疫细胞和基质细胞,它们共同构成了一个复杂且动态的生态系统。近年来,随着高通量测序技术的发展和计算生物学方法的进步,科研人员能够借助基因表达数据,通过细胞去卷积手段深入解析肿瘤组织中的各种细胞类型分布与其相互作用。尤其是针对不同肿瘤类型的全癌种(pan-cancer)系统分析,为理解肿瘤微环境的异质性提供了强有力的工具,并揭示了这一微环境在临床预后与分子突变层面的多重影响,为临床治疗策略尤其是免疫治疗提供了理论支撑。传统的单一去卷积方法通常只能解析有限的细胞类型,无法充分反映肿瘤微环境的复杂性。而通过整合多达九种不同的计算去卷积工具,可综合评估超过七十九种肿瘤微环境中的免疫和基质细胞类型,显著提升解析深度和精确性。
这一创新性的整合分析方法不仅证实了免疫细胞,特别是白细胞在区分不同癌种中的核心作用,还发现了包含丰富免疫浸润的肿瘤微环境亚群与患者预后改善之间的密切联系。以膀胱癌和黑色素瘤为例,研究发现在特定亚型中,免疫富集群体呈现出更佳的生存优势,指示肿瘤微环境的免疫构成可能成为预后和治疗反应的重要标志。通过对基因表达数据的系统性去卷积,这项研究团队综合考虑了不同肿瘤样本中各种免疫细胞(如细胞毒性T细胞、调节性T细胞、巨噬细胞等)、基质细胞(包括纤维母细胞、内皮细胞、周细胞)以及相关肿瘤微环境功能性过程(如缺氧、血管生成等)的分布特征。值得注意的是,这种方法还对比验证了多种独立数据来源,如DNA甲基化分析、H&E染色组织切片影像及T细胞受体丰度测定,实现了多层次、多渠道的结果确认,使得整合得分(iScore)体系更具科学说服力与稳定性。肿瘤微环境中免疫细胞的异质性表现极为复杂。在不同的癌种及亚型中,白细胞总量及其亚群分布存在明显变异。
比如血液系统肿瘤如弥漫性大B细胞淋巴瘤(DLBCL)和胸腺瘤(THYM)通常具备较高比例的免疫浸润,而免疫特权部位的肿瘤如眼部色素瘤(UVM)和低级别胶质瘤(LGG)则展现出较低的浸润水平。除了白细胞总数外,特定免疫细胞类型与临床预后表现出癌种依赖性的关联。例如,CD8+细胞毒性T淋巴细胞通常与较佳的预后关联,而某些免疫抑制细胞如调节性T细胞在肾透明细胞癌(KIRC)等癌种中则显示出与不良预后的相关性。基质细胞群体在肿瘤微环境中的作用同样不容忽视。通过细致的去卷积分析,研究揭示了基质细胞如内皮细胞和癌相关纤维母细胞(CAFs)在不同肿瘤中对疾病进展的双向影响。东侧案例中,内皮细胞富集与某些癌种较低的进展风险相关,而CAF则往往与促进肿瘤侵袭和不良预后联系紧密。
值得强调的是,免疫细胞和基质细胞之间存在显著的相互作用和共调控机制,这种免疫-基质交互作用在决定肿瘤生长环境和治疗敏感性方面发挥着重要作用。通过对临床随访数据的整合分析,免疫和基质iScore均被证明具有指导疾病预后的潜力。在整体癌种层面,免疫活跃型肿瘤微环境通常对应更低的疾病进展风险,而在脑胶质瘤等某些特定癌种中,复杂的免疫抑制机制可能导致免疫细胞浸润与预后负相关,这提示肿瘤微环境的解读需要结合癌种生物学背景进行动态调整。肿瘤突变负荷(TMB)与免疫细胞丰度之间的关系一直是免疫治疗响应预测中的重要问题。本研究通过大规模数据分析发现,TMB与免疫浸润之间无显著的泛癌种相关性,但在部分癌种中二者间存在显著关联,从而提示不能单一依赖TMB指标预测免疫反应。此外,驱动基因的特定突变状态显著影响肿瘤微环境构成。
例如,免疫通路相关基因如CASP8的突变通常与广泛的免疫细胞增多相关,暗示肿瘤可能通过调控这些基因逃避免疫监视;而RAS通路相关基因NRAS的突变则与多种免疫细胞相对缺乏相关,表现出潜在的免疫排斥效应。局部突变热点如膀胱癌中FGFR3的特定突变也显示出与免疫微环境抑制型表型相关,提示这些突变可能成为调控肿瘤免疫生态的重要靶点。对于临床实践,这种基于大规模全癌种数据的肿瘤微环境细胞谱图的建立提供了精准分类和风险预估的新工具。通过识别肿瘤内部免疫和基质细胞的多样组合模式,可分辨出预后良好与预后不佳的肿瘤群体,指导个体化免疫治疗策略的制定。此外,明确特定突变与免疫逃逸机制之间的联系,有助于开发针对肿瘤微环境进行靶向调控的创新疗法,增强免疫治疗效果。尽管单细胞转录组和空间组学技术为深入理解肿瘤微环境带来了前所未有的机会,但高成本、复杂的实验流程及细胞类型的丢失问题限制了其广泛应用。
基于传统肿瘤组织的批量RNA测序数据,通过综合运用先进的去卷积算法实现高精度的细胞类型估计,成为目前解析肿瘤微环境的高效、经济的替代方案。未来,随着数据规模不断扩大和算法不断优化,这种综合多算法整合的策略将在临床肿瘤学、药物研发及基础研究中发挥重要作用。综合来看,免疫和基质细胞的去卷积技术不仅极大丰富了对肿瘤微环境异质性的认知,也为疾病预后判断和治疗方案的优化提供了科学依据。面向未来,结合单细胞组学数据、空间定位信息以及多组学联合分析,将进一步推动我们对肿瘤微环境的全面理解,开拓更加精准的肿瘤免疫治疗路径,最终提升患者的生存率和生活质量。