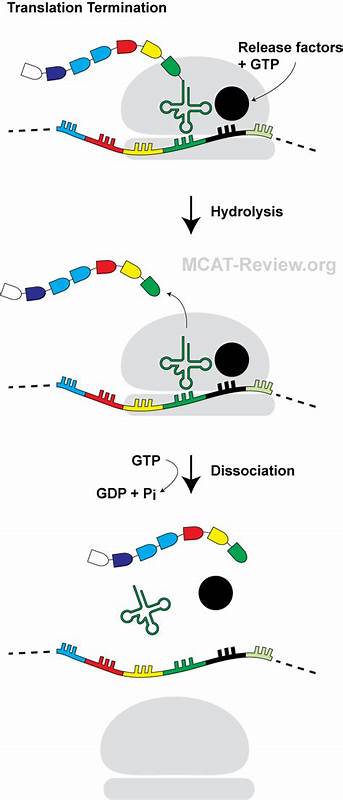
蛋白质合成是生命活动的核心过程,负责将遗传信息翻译为功能性蛋白质。翻译的终止阶段对于确保蛋白质合成的准确性与效率至关重要。近期研究揭示,一种源自大肠杆菌的迷你发卡形状新生肽——PepNL,通过一种迄今为止未被发现的独特机制,成功阻断了翻译终止过程,展现了新生肽介导翻译调控的复杂性和多样性。这一发现为理解细胞内基因表达的调控机制提供了全新视角,也为未来开发新的分子调控工具奠定基础。 蛋白质翻译的终止依赖于释放因子(如RF2)识别mRNA中的终止密码子,促使肽链从tRNA上催化水解释放。传统观念认为,该过程具有高度的稳定性和专一性。
然而,越来越多的研究表明,新生肽在核糖体出口通道中通过特定的氨基酸序列与核糖体结构相互作用,能够诱导翻译暂停或终止失败,进而调节蛋白质表达水平。PepNL的独特之处在于,其仅由14个氨基酸组成,却能够形成迷你发卡式的结构,并通过该结构阻止RF2的功能实现翻译终止的阻断。 通过高分辨率的冷冻电子显微镜技术,研究人员重构了PepNL驻留于细菌70S核糖体内的三维结构。结果显示,PepNL新生肽的N端折回至核糖体出口通道入口附近,形成一个稳定的迷你发卡环结构。该结构通过关键的疏水性交互作用及β折叠样式的主链氢键网络保持稳定。令人惊奇的是,这种逆向折叠的构象与一般新生肽顺向延伸的模式截然不同。
该迷你发卡结构的形成导致肽链C端的13号异亮氨酸发生扭曲,向肽酰转移中心(PTC)内的关键位置插入,占据了释放因子RF2中GGQ保守催化动机所必需结合的空间,从而阻挡释放因子正常定位与肽链水解。该空间由23S rRNA的特定核苷酸构成,是实现肽链释放的核心部位。PepNL的异亮氨酸通过空间错位产生明显的立体阻碍,使得GGQ动机无法入位,诱发释放因子结构的异常折叠,终止酶活性大幅降低,翻译终止被阻断。此过程非常精细,甚至微小的氨基酸替换均能消除这种阻断效应,彰显特定残基作用的关键性。 此外,PepNL通过自身独特的氨基酸序列即能实现翻译终止阻断,无需依赖传统相关的“阻断诱导剂”。但令人大为欣喜的是,细菌内天然存在的色氨酸转运tRNA(Trp-tRNATrp)能够作为“阻断抑制因子”,通过解读UGA终止密码子,引发“读过”效应,让核糖体跳过阻滞点继续延伸。
实验中,通过剔除体外系统中的色氨酸,观察到PepNL引发的翻译阻断明显增强,反之补充色氨酸则减轻阻断现象。这种机制展现出一种由核糖体翻译动态与新生肽折叠时间窗交织而成的复杂调控模式。 PepNL迷你发卡肽阻断翻译终止的机制具有多方面的生物学意义。首先,它拓展了已知的翻译调控机制类型,区别于经典的依赖代谢物或环境信号诱发的翻译阻断,新生肽本身即包含完整的调控信息。其次,这种调控模式模糊了核糖体结构动态变化与翻译终止效率的界限,强调了局部肽链构象对功能执行的制约作用。再次,通过调控下游基因pepN的表达,PepNL能间接影响细菌内蛋白质降解系统与氨基酸代谢,促进环境适应与资源利用优化。
PepNL的发现依托于结合过表达表型筛选、质谱技术和高分辨率结构解析的综合策略,为寻找和鉴定致翻译阻断的新生肽打开了新思路。在筛选阶段,研究者观察到特定小开放阅读框架(sORFs)表达引发细菌生长显著抑制,推断为翻译阻断导致氨基酰tRNA枯竭或核糖体功能异常。随后通过液相色谱-质谱联用分析确认了肽链从翻译中断位置积累的肽酰-tRNA分子。最终利用冷冻电镜技术定位并解析了PepNL肽链与核糖体及释放因子之间的精细相互作用,揭示了其阻断机制的分子基础。 这项研究的深入揭示了新生肽在翻译调控中的潜在多功能性。PepNL所表现出的逆向折叠迷你发卡结构,提出了新生肽结构多样性的概念,表明新生肽不仅是被动的产物,而是能够主动塑造翻译动态的关键调节因子。
类似结构的形成可能也存在于其他未知功能的新生肽,提示了未来探索微小蛋白质功能的新方向。 在调控层面,PepNL利用UGA密码子的读过效应作为翻译阻断的抑制机制,这种机制的时间依赖型特性暗示了折叠动力学与翻译速率的精细平衡有助于细胞动态响应营养环境的变化。此外,这一机制的发现也为合成生物学设计提供了启示,例如设计可控翻译终止的合成肽链,以实现蛋白质表达的精密调控。 尽管PepNL展现出明确的生物学功能,目前的研究仍存在诸多待解问题。例如其在不同环境条件及细菌种类中的保守性及调控范围,新生肽结构折叠的动力学细节,以及翻译阻断机制与细胞内其他翻译质量控制途径的交互关系,都需要进一步系统的研究。更为深入的生化实验与高通量筛选,以及单分子层面的动态观察,将极大促进对该机制的理解。
总的来看,PepNL迷你发卡肽通过采用全新的方式阻断翻译终止,展现了新生肽介导翻译调控的复杂性和多样性。这不仅深化了我们对蛋白质合成机制的认识,也为开发新型抗菌策略、调控蛋白表达和合成生物学工具提供了宝贵的理论依据和技术基础。随着相关研究的深化,未来可能会涌现更多类似功能的新生肽,推动分子生命科学进入一个崭新的范式时代。