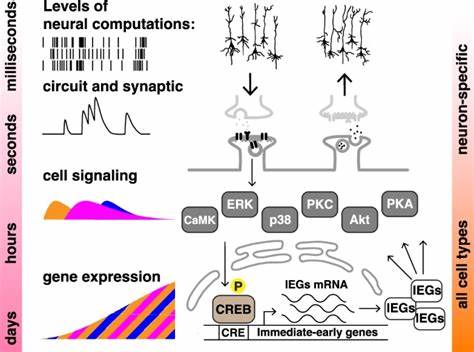
学习与记忆一直被视为高级神经系统中的核心功能,尤其显著体现在动物大脑复杂的神经回路和突触塑性中。其中,间隔学习效应,即通过分散时间的重复训练比连续集中训练能形成更坚固持久的记忆,已被多个物种和神经网络证实。然而,令人惊讶的是,最新科学研究揭示,非神经的哺乳动物细胞也能表现出类似间隔学习的效果,从而挑战了传统关于记忆依赖神经结构的认知,开启了跨细胞类型的记忆研究新方向。间隔学习效应最早由心理学家赫尔曼·艾宾浩斯记录,指的是训练间合理安排的时间间隔能够显著增强学习效率和记忆保持。神经科学研究通常将这一定律归因于神经元信号的时间整合和突触可塑性调整。然而,细胞信号传导本身具备动态时序整合能力,尤其是涉及关键分子如蛋白激酶A(PKA)、蛋白激酶C(PKC)、细胞外信号调节激酶(ERK)以及转录因子CREB(cAMP反应元件结合蛋白)的复杂网络,能够在细胞内实现信息的时序解码与长期响应。
通过在非神经细胞中引入模仿神经元的学习刺激模式,科学家们惊喜地发现,即使缺乏完整神经网络,细胞依然能够“识别”训练的时间间隔,实现信号和转录水平的记忆效应。在这项创新研究中,研究团队选用了人类神经母细胞瘤细胞系SH-SY5Y和人类胚肾HEK293细胞,两者均被稳定转染带有短寿命荧光报告基因的cAMP反应元件(CRE)依赖性荧光素酶表达载体。以活化PKA的福斯可林和激活PKC的TPA作为刺激因子,通过控制单次或多次短促脉冲训练,模拟间隔学习与集中学习两种不同模式。在实验结果中,四次间隔约10分钟的脉冲刺激相比单次集中持续刺激,显著增强了CRE介导的基因表达,且这种增强效应在24小时后更为显著,呈现出间隔学习的典型特征。此外,多脉冲刺激也诱导了ERK与CREB的更强烈和更持久的磷酸化修饰,这些信号转导事件是神经形态记忆形成的分子基础。通过加入ERK抑制剂和CREB转录活性抑制剂实验进一步验证,阻断这些关键节点将完全或部分抑制间隔效应,确认了信号网络在非神经细胞记忆样效应中的核心作用。
这些发现提出了一个重要观点:记忆的核心机制并非神经元独有,而是植根于进化保守的分子信号动态中,且细胞能够通过时序信号调节实现模式识别和长期信息存储。这不仅扩展了对“细胞认知”范畴的理解,也为大规模细胞模型下高效解析记忆形成机制提供了可能。非神经细胞的快速生长和高通量特性,使其成为探索基因表达调控、信号传导网络及其时序整合规律的理想模型。相比神经元细胞,这种系统无需复杂培养条件且易于进行批量化实验,为药物筛选、认知障碍治疗策略开发和认知增强研究奠定了坚实基础。研究还指出,PKA和PKC在对训练刺激时的敏感性存在差别,PKA对刺激持续时间更为敏感,而PKC则更多响应事件数量,这种信号特性或为生物体如何通过不同神经调质调控记忆形成提供微观解释。ERK的磷酸化及其核转位进一步强调信号氛围与转录激活的联动模式,是时间模式输入转化为长效基因表达的关键桥梁。
该研究跨越了细胞生物学与神经科学的界限,彰显信号网络机制驱动的学习和记忆特性可广泛存在于生命系统中的多种细胞类型中。未来工作将探讨信息输入模式如何精细调控信号通路之间的相互作用,实现多层级的记忆形成,同时解析不同细胞类型在转录调控和信号持续性方面的差异。此外,利用该模型还能够定量揭示基因转录动态在认知过程中的作用,助力设计优化的训练方案以提升学习效果。对于临床应用,理解非神经细胞中记忆效应的分子基础,可为脑功能障碍患者提供创新治疗目标,比如调控ERK-CREB途径改善认知损伤,或开发新型认知增强剂。整体而言,非神经人类细胞中发现的间隔学习效应颠覆了传统记忆存在于仅神经系统的认知,凸显了细胞水平信号整合的复杂性与多样性。这既深化了对生命信息处理基本规律的认知,也为多学科交叉研究和转化医学应用打开新篇章。
未来借助更高通量和自动化平台,科学家将有望绘制出更为精确的细胞记忆动力学模型,助力理解从分子机制到行为表现的桥梁构建。如此,间隔学习效应不仅是神经系统的特权,更是生命细胞适应环境、实现信息存储与选择响应的普遍策略。非神经细胞中由PKA、PKC、ERK及CREB通路构成的信号网络展现出对时序训练模式高度辨识和记忆的能力,进一步证明了生物系统越发复杂的信号流程和转录调控是如何支撑更高层次功能的基础。该发现鼓励我们从单细胞和分子层面重新定义“学习”和“记忆”,将其视为广泛存在于细胞群体中的动态适应与信息处理现象。