阿尔茨海默症是一种复杂且逐渐加重的神经退行性疾病,影响着全球数千万患者的生活质量和寿命。尽管科学界投入了大量资源试图揭开其发病机制和开发有效疗法,但迄今为止仍未攻克这一重大医学难题。然而,最近一项备受关注的研究发现,一种名为Christchurch的罕见基因突变,通过调节大脑炎症反应,显著延缓了阿尔茨海默症的病理进程,为疾病治疗带来了新的希望。 Christchurch突变存在于位于APOE基因内的一个特定变异,APOE基因编码的是载脂蛋白E,这是一种关键的胆固醇转运蛋白,在神经系统的正常功能中起着重要作用。在阿尔茨海默症研究中,APOE基因的多个亚型与疾病风险密切相关,而Christchurch突变的发现则为这一领域注入了全新的基因保护机制的概念。 这一突变最初是在研究一个来自哥伦比亚的大家族中发现的,该家族中存在遗传性早发型阿尔茨海默症的高发病率,患者通常在50岁左右就出现严重的认知障碍。
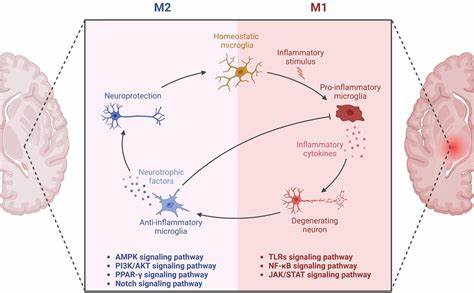
然而惊人的是,一名携带双拷贝Christchurch突变的女性尽管脑内累积了大量的淀粉样蛋白,但其认知功能却异常健康,且伴随的tau蛋白水平显著降低。这一发现立刻引发科学界对Christchurch突变保护作用机制的深入探究。 在最新由Weill Cornell Medicine主导的研究中,科学家们通过基因编辑技术将Christchurch突变引入患有tau蛋白积累的鼠模型中。结果显示,这种突变不仅减缓了tau蛋白的异常聚集,也有效缓解了突触损伤和大脑活动紊乱,全面改善了模型动物的神经功能。这些发现从根本上挑战了传统上以淀粉样蛋白为主要治疗靶点的认知框架,凸显了tau病理和神经免疫炎症的关键作用。 研究进一步揭示,Christchurch突变通过抑制cGAS-STING信号通路发挥其保护效应。
cGAS-STING通路是细胞内先天免疫系统中的一个重要环节,主要负责检测细胞中异常DNA并启动炎症反应。在阿尔茨海默症及其他神经退行性疾病中,该通路被异常激活,导致持续的炎症状态,加剧神经损伤和认知衰退。Christchurch突变有效“驯服”了这一通路,显著降低了脑内炎症水平,为保持神经元健康提供了有力保障。 此外,研究特别强调了大脑免疫细胞微胶质细胞在阿尔茨海默症炎症过程中的核心地位。微胶质细胞在正常情况下负责清除脑内垃圾和维持神经环境稳定,但在阿尔茨海默症患者中,持续激活的微胶质细胞会释放大量炎症因子,加剧疾病进展。Christchurch突变通过抑制cGAS-STING信号,减弱了微胶质细胞的炎症反应,阻断了有害的神经炎症循环。
令人振奋的是,研究团队利用药物抑制剂模拟这一突变的作用,成功阻断了cGAS-STING通路,显著缓解了模型鼠的神经病理变化和认知缺陷。这一发现表明,虽然我们无法直接将Christchurch基因突变应用于人类,但通过靶向同一信号通路进行药物干预,完全有可能开发出有效的阿尔茨海默症治疗手段。 阿尔茨海默症的发病机制一直备受争议,传统观点强调淀粉样蛋白的沉积是病理关键,但越来越多的研究表明,tau蛋白的异常聚集及其引发的神经炎症过程才是疾病进展的真正驱动力。Christchurch突变研究切实印证了这一点,也为未来治疗打开了新的思路——通过精准调节神经免疫信号,减轻大脑炎症,有望延缓甚至逆转疾病。 当前,阿尔茨海默症的治疗手段极为有限,绝大部分疗法只能针对症状进行缓解,缺乏根本改善病程的有效方法。Christchurch突变揭示的cGAS-STING信号通路调控机制,为开发具有病因修正潜力的靶向药物提供了明确方向。
随着小分子抑制剂和生物技术的不断进步,未来有望实现精准治疗,将神经炎症控制在可控范围内,极大提升患者的生活质量。 除了阿尔茨海默症,cGAS-STING通路与其他多种神经退行性疾病如帕金森病、亨廷顿舞蹈症等也有密切联系。深入理解和调控这一通路,不仅有助于阿尔茨海默症的治疗,也将推动整个神经科学领域的进步。 值得注意的是,Christchurch突变的研究彰显了基因变异在疾病防护中的潜力,提醒人们基因组学与精准医疗的重要性。未来,在基因编辑、分子药物等高端技术的支持下,个体化治疗或将成为可能,对早期诊断和预防提供了坚实基础。 综上所述,科 学家对Christchurch基因突变的揭示不仅深化了对阿尔茨海默症病理机制的理解,更开辟了针对神经炎症的新疗法路径。
通过靶向cGAS-STING信号通路,调节微胶质细胞炎症反应,未来有望开发出更有效、更具针对性的治疗方案,帮助广大患者重获更长久的认知健康。随着相关临床研究的推进,这一突破性发现有望引领神经退行性疾病治疗进入新时代,带来福音与希望。