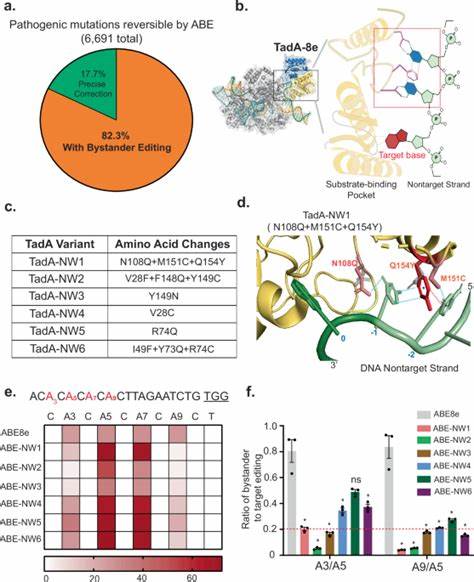
碱基编辑技术作为近年来基因组编辑领域的一项革命性进展,为修复多种遗传性疾病提供了新的可能。不同于传统的CRISPR-Cas9系统通过制造双链断裂诱导细胞自然修复,该技术无需依赖修复模板,即可实现单碱基的精确替换,有效破坏或修复致病变异。然而,当前大多数碱基编辑器普遍存在编辑窗口跨度较宽的问题,导致除目标碱基外,邻近的可编辑碱基也被意外修改,产生"旁观者编辑"现象,严重影响精准度和安全性。针对这一关键瓶颈,科学家们设计了一种简化且结构指导的碱基编辑器工程策略,通过引入天然的寡核苷酸结合模块,提高编辑器对非目标链单链DNA的结合亲和力和特异性,从而稳定substrate构象并缩小活性窗口,显著降低了非目标碱基的误编辑风险。 该策略起源于对目前高效腺嘌呤脱氨酶TadA-8e结构的深入理解。TadA-8e是目前效率最高的去氧腺苷脱氨酶之一,广泛应用于腺嘌呤碱基编辑器(ABE)结构。
然而其10个碱基宽的编辑窗口往往导致大量旁观者碱基的非特异性脱amination。通过引入结构中天然存在于人类Pumilio1 RNA结合蛋白的多种氨基酸残基组合,研究团队成功开发了新的TadA衍生变体 - - TadA-NW1,新变体在活性中心添加了具有层叠作用的芳香族氨基酸残基和能够进行氢键和静电相互作用的极性残基,稳定了非目标DNA链的U状单链构象。 功能验证实验在HEK293T细胞系和多种内源基因位点展开。结果表明,TadA-NW1融合多种Cas9单链切口酶后,无论是传统的SpCas9,还是针对不同Protospacer Adjacent Motif(PAM)序列的NG-Cas9及VRQR-Cas9,都实现了高度集中的A-to-G编辑活性,编辑窗口缩窄至仅包含4个碱基,相较于宽达10个碱基的ABE8e,旁观者编辑比例降低了数十倍,且在保持峰值编辑效率的同时,大大改善了基因改造的精准性。该新型编辑器同时表现出对Cas9依赖与非依赖性脱靶DNA区域的较低编辑活性,表现出极佳的特异性和安全性。 此外,研究团队以能够引发C·G到T·A转换的Td-CBEmax(细胞色素碱基编辑器)和实现A·T至C·G转变的ACBE为基础,将TadA-NW1相应的结构改造导入腺苷脱氨酶域,获得了优化的Td-CBE-NW和ACBE-NW编辑器。
两者不仅保持了原有的有效碱基转化能力,同时达到了显著收窄活性窗口,增强了对目标碱基的专一性。该成果标志着工程策略的通用性,不再局限于腺嘌呤编辑,具备广泛的应用潜力。 对比同类编辑器中曾被推广的具有高度单碱基识别特异性的ABE9,TadA-NW1体现出更为灵活的靶点适应性。ABE9的应用范围由于依赖于特定位置的腺嘌呤存在而受限,编辑效率在无合适位点时显著下降。相反,TadA-NW1能够在较宽泛的碱基位置区域内有效编辑,适用性更广,满足更多临床场景的需求。进一步去除组成编辑器的柔性连接肽后,TadA-NW1甚至可实现与ABE9相媲美的极窄编辑窗口,为后续精细化设计提供了坚实基础。
为了验证该策略在实际治疗中的潜力,研究者将ABE-NW1应用于最常见且难以治疗的囊性纤维化(CF)致病突变CFTR W1282X修复。该位点包含多个邻近可编辑碱基,传统ABE8e修复时伴有高比例的旁观者突变,导致蛋白床表达及功能异常。相较之下,ABE-NW1结合新设计的目标特异性sgRNA(利用非典型NAG PAM定位),实现了超过三分之一的完美单碱基修复,旁观者修改率显著下降。功能性检测显示,ABE-NW1处理后细胞的CFTR蛋白表达量明显优于ABE8e组,氯离子通导率亦显示更佳修复效果,专业化评估确认了其修复的有效性与安全性。 从分子机制上来看,通过提升脱氨酶与单链DNA非目标链的结合强度与特异性,稳固其在酶活性中心的构象,降低旁观者碱基的接触性和脱氨速度,实现精准定位。这极大缓解了传统脱氨酶作用范围宽泛导致的脱靶风险,充分体现了天然蛋白结合模块在蛋白质工程中的巨大价值。
该策略以结构为导向,结合模仿自然结合域的演化思路,实现了编辑器性质的跃升。 相比其前身大规模蛋白质随机突变筛选方式,该工程策略更为高效,节省时间和人力资源,推动快速开发与优化针对多样靶标的碱基编辑器。基于这一框架,还可进一步借助人工智能驱动的蛋白质结构预测技术如AlphaFold,持续解锁更多潜在编辑器设计可能,助力多种基因组编辑任务的精准化。 该研究不仅在碱基编辑技术向临床转化道路上迈出了关键一步,也为基因治疗靶点难点的突破注入了新动力。随着该技术推广至更多疾病模型及体内验证,有望引领一代更安全、高效和精准的基因编辑疗法诞生,造福众多罕见及复杂遗传病患者。未来工作仍需对不同细胞类型、复杂组织环境及长期安全性进行深入评估,以期早日实现碱基编辑技术的广泛临床应用。
综上,该简化且精确的碱基编辑器工程策略堪称基因编辑领域的一项里程碑,彰显了结构生物学与蛋白质工程深度融合带来的革新潜力。 。