阿尔茨海默病是全球范围内最常见的痴呆类型,随着人口老龄化,发病人数持续攀升。尽管近年来抗淀粉样蛋白的抗体药物在临床试验中带来一些减缓认知衰退的证据,但对许多患者尤其是携带致病基因突变的早发性病例而言,现有治疗仍然有限。基因编辑技术,尤其是以CRISPR为代表的工具,被寄予厚望,有望对某些遗传相关的阿尔茨海默病实现根本性干预,甚至一剂治愈式的长期疗法。然而,从实验室到临床仍有漫长而复杂的路径。以下从科学原理、潜在靶点、最新研究证据、关键技术难题、伦理与监管及未来发展方向做系统性解析,帮助读者理解基因编辑如何在阿尔茨海默病领域发挥作用及面临的现实问题。 首先了解CRISPR基因编辑的基本概念很重要。
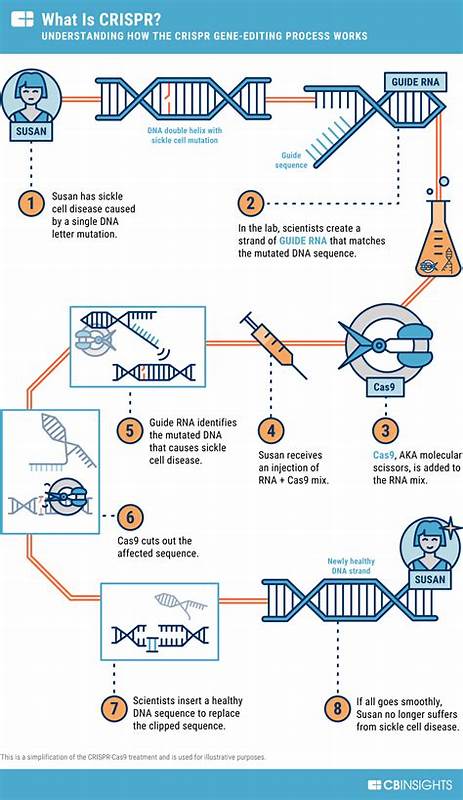
CRISPR-Cas系统源自细菌的免疫机制,研究者将其改造为可在哺乳动物细胞中精准切割特定DNA序列的工具。Cas9等核酸酶受导向RNA引导,在目标位点产生断裂,随后细胞自身的修复机制可以被利用来敲除基因、插入序列或在更精细的技术如碱基编辑和Prime编辑下实现单碱基替换。相较于传统小分子药物,基因编辑的魅力在于可能实现一次性、长期性的疗效,尤其适合由单一或少数基因突变驱动的疾病。 阿尔茨海默病的病因非常复杂,既有环境与年龄因素,也有遗传成分。家族性早发性阿尔茨海默病通常由APP、PSEN1或PSEN2等基因的突变引发,这类病例更适合采用基因编辑的策略进行根治性干预。晚发性阿尔茨海默病则以APOE基因变体影响风险最为明显,携带APOE4等位基因的人群罹患风险显著上升。
基于这些基因背景,研究者提出了多种可能的基因编辑策略,包括破坏致病等位基因、修复或替换突变、模拟天然的保护性突变,以及调控基因表达以降低有害蛋白的生成或传播。 在靶点选择上,APOE和PSEN1是两类具有代表性的目标。APOE编码脂蛋白E,参与神经系统脂质代谢并影响淀粉样蛋白和tau的处理。APOE4显著增加阿尔茨海默病风险,而APOE2则有保护作用。研究者试图通过基因编辑将APOE4等位基因"转变"为更安全的形式,或者直接降低APOE4的表达。在一项引人注目的研究中,科学家发现一种罕见的Chrishcurch样变体在携带致病突变的个体身上延迟了症状出现。
团队利用CRISPR在小鼠模型中模拟这一保护性变体,结果显示携带该变体的小鼠在多方面表现出对病理进展的部分或完全保护,这为通过基因编辑模拟保护性突变提供了先导证据。 针对PSEN1等早发性阿尔茨海默病相关基因的研究也显示出可行性。PSEN1编码γ-分泌酶的关键亚基,突变会增加有毒的Aβ42产量,从而加速淀粉样蛋白斑块形成。通过CRISPR对致病等位基因进行选择性破坏或校正,研究人员在体外细胞实验中实现了PSEN1突变的降低并伴随Aβ42水平均衡下降。更先进的编辑方法如Prime编辑可以实现单碱基替换,这对于那些由单碱基突变引起的疾病尤其重要。 尽管概念诱人,但将CRISPR用于脑内基因编辑面临独特且艰巨的挑战。
第一个重大障碍是递送。要在脑组织中实现广泛而持久的基因编辑,需要将编辑工具高效、安全地输送到目标细胞。病毒载体如腺相关病毒(AAV)因其在神经系统中的相对高效传递和低致病性被广泛采用,但AAV载体存在包装容量限制、潜在免疫反应以及在大脑不同区域分散递送的难题。脂质纳米颗粒等非病毒载体在脏器递送上取得了进展,但跨越血脑屏障、高选择性到达神经元或小胶质细胞仍需更多优化。另一个策略是体外编辑后再回输患者细胞(ex vivo),如对造血干细胞的编辑已在血液病中取得临床突破,但对于需要编辑神经细胞的阿尔茨海默病,这一路径并不直接适用。 安全性是另一个核心问题。
CRISPR编辑并非总是完美的,可能出现离靶效应导致其他基因突变,甚至发生染色体重排或大片段缺失,这在脑组织中尤其令人担忧,因为神经元的非复制特性意味着任何不可逆的损伤都可能长期存在。免疫反应同样是隐忧:体内递送CRISPR相关蛋白可能被宿主免疫系统识别并清除,或引发炎症,反而加剧神经退行性病理。长期监测与严格的安全评价在临床试验中不可或缺。 伦理和社会层面的考量也不可忽视。基因编辑对人类基因组进行潜在永久改变,涉及代际影响、知情同意、治疗公平性与费用可及性等问题。对于尚无治愈手段的疾病来说,患者与家属对快速进入临床试验有强烈需求,但监管机构须在保护受试者安全与促进创新之间取得平衡。
另一个伦理难题是受试者选择 - - 家族性早发性阿尔茨海默病患者由于其明确的致病基因,可能成为最早的受益人群;而针对更常见的散发性晚发性阿尔茨海默病,基因编辑的目标与受益群体则更为复杂且不确定。 从技术进展看,近年来几项重要成果为脑部基因编辑的可行性提供了支撑。首例获批的体内CRISPR疗法用于血液病,标志着基因编辑临床化的阶段性胜利;实验室与动物模型研究显示,通过编辑APOE或PSEN1可以在分子层面改变与阿尔茨海默病相关的病理过程。此外,新一代编辑工具如碱基编辑和Prime编辑减少了依赖双链断裂的风险,能以更高精度完成碱基替换或小片段校正,从而降低潜在的基因组结构性损伤。然而,工具的精度提升必须在更高水平的体内环境中反复验证,包括在灵长类动物模型中的安全性与有效性评估。 临床转化路线将是分阶段推进的过程。
早期主要聚焦于那些有明确致病基因并且发病机制单一清晰的患者群体,例如由PSEN1/PSEN2或APP突变导致的家族性早发病例。临床试验首先要证明安全性,随后证明生物标志物层面(如脑脊液Aβ42、tau水平或PET成像)与临床认知功能的改善。在早期试验中,短期内的安全和生物学证据将是关键决策点。若安全性可控,进一步扩大样本、延长随访、并评估长期效果与潜在副作用将成为下一步。对于散发性晚发性阿尔茨海默病,更可能采取基因表达调控、模拟保护性变体或靶向免疫与炎症通路的混合策略,而非单一"修复一个基因"的思路。 成本与可及性也是未来必须面对的问题。
基因疗法通常研发投入巨大,生产标准高,导致上市后价格昂贵。如何让可能有显著益处的基因编辑疗法被更广泛的患者所获得,涉及医疗保险覆盖、生产工艺优化以降低成本、以及全球健康公平性的政策考量。 尽管挑战重重,基因编辑在阿尔茨海默病研究中的前景并非空想。可能的临床应用场景包括为早发性单基因致病患者提供一次性校正治疗、为高风险基因携带者提供风险降低的"基因改造"策略、或在多药联用中作为减少致病蛋白生成的长期手段。研究者也在探索将基因编辑与免疫疗法、抗炎疗法、神经保护策略结合,用于多靶点、个体化的治疗方案。 未来研究需要集中在几个方向:提高编辑工具的精准度与可控性;开发更安全高效的脑内递送载体;建立更完备的实验动物模型,尤其是非人灵长类模型上的长期安全性数据;完善临床试验设计,优化生物标志物与早期终点指标;以及建立透明且公正的监管与伦理框架。
与此同时,公众教育也很重要,让患者和公众理解基因编辑的潜力与风险,避免过度期望或恐慌。 作为公众或患者家庭,关注基因检测和遗传咨询、了解正在进行的临床试验、支持基础科学与临床研究的资助是可行的行动方向。在与神经科医生讨论时,可以询问关于基因检测的适用性以及是否有适合的研究项目。在科学与伦理都成熟之前,任何基因编辑干预都应在严格监管与知情同意的前提下进行。 总之,CRISPR及相关基因编辑技术为阿尔茨海默病的治疗带来了前所未有的可能性,尤其是在针对明确遗传致病因素的病例中具有变革性潜力。然而,技术从实验室到临床的跨越并非单一科技能解决,而需整合生物学、材料学、临床医学、伦理学与公共政策的协同推进。
未来若能克服递送、安全性与成本等瓶颈,基因编辑或将成为阿尔茨海默病预防与治疗的重要工具之一,为患者带来更持久的希望。继续关注相关临床试验、技术进展和监管动态,将有助于追踪这一领域的实际落地与社会影响。 。