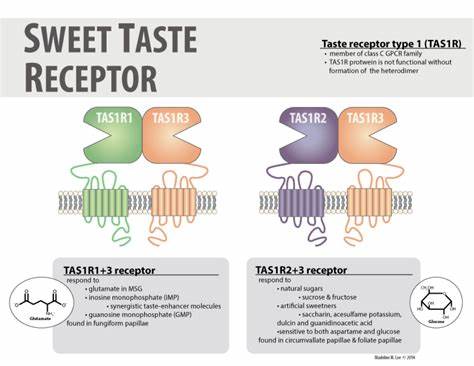
甜味作为人类基本味觉之一,不仅影响着我们的饮食选择,还与代谢健康密切相关。人类甜味受体由TAS1R2和TAS1R3两个亚基组成,是一种典型的C类G蛋白偶联受体(GPCR),能够感知从天然糖类到人工甜味剂乃至甜味蛋白的多种甜味物质。尽管甜味受体的生理功能早已得到确认,但因缺乏详尽的三维结构信息,其具体的分子识别机制和信号传导过程一直未被充分揭示。近期,科学家们借助先进的冷冻电镜技术,首次成功解析了人类甜味受体的全长结构,分别获得其无配体状态和与甜味剂蔗糖醇结合后的构象,极大地推动了该领域的研究进展。 解析结构显示,人类甜味受体呈现明显的非对称异源二聚体架构,其中蔗糖醇只特异性地结合到TAS1R2亚基的“捕蝇草”域(Venus flytrap domain,VFTD)中。TAS1R2的VFTD形似一个闭合的夹钳结构,能够捕获甜味分子并诱导蛋白构象的显著变化,进而触发受体的活化。
这一发现通过系统突变实验以及结合分子动力学模拟得到了验证,有助于揭示不同甜味分子与TAS1R2的结合模式及其对受体激活效应的特殊贡献。相比之下,TAS1R3 亚基更多地参与调节受体的整体构象和信号传递,而非直接识别甜味配体。 与其它C类GPCR受体相比,甜味受体具有独特的活化机制。其VFTD通过结合甜味分子发生闭合,导致相邻结构域的旋转和挤压,进而调控TAS1R2和TAS1R3的转膜域构象,激活下游G蛋白信号通路。这种构象从无配体状态向蔗糖醇结合状态的转变,展示了甜味受体内部复杂的异构调控网络,体现了其对多种甜味刺激的高灵敏度和选择性。该机制也与谷氨酸受体和γ-氨基丁酸受体等其他成员显示出部分共性,但在具体分子细节和活化动力学上呈现差异,凸显甜味受体的独特功能定位。
甜味受体不仅局限于口腔中的味蕾表达,也在肠道、胰腺乃至中枢神经系统中有重要分布。这些受体在调控糖代谢、胰岛素分泌和能量平衡中扮演关键角色。例如,受体激活后能促进Na-葡萄糖协同转运蛋白的表达,提高肠道对葡萄糖的吸收,同时刺激胰腺β细胞释放胰岛素。这种多层次的调节机制使甜味受体成为糖尿病及代谢综合征治疗的新靶点。对其结构和功能的深入理解,有助于开发既能满足味觉体验又能调节代谢的创新甜味剂和疗法。 在甜味剂设计层面,冷冻电镜解析的结构为科学家准确定位不同甜味分子的结合口袋和关键氨基酸残基提供了坚实基础。
蔗糖醇以及其它人工甜味剂如新甜蜜素和甜菊糖苷均通过不同的结合模式激活TAS1R2,部分甜味蛋白则与受体表面特定的多个结合点多重相互作用,这些信息帮助设计出更具亲和力和选择性的甜味分子。在深度学习辅助分子对接和动力学模拟的助力下,新一代甜味剂不仅口感接近天然甜味,还能最大程度降低对人体代谢的潜在负面影响。 此外,甜味受体的基因多态性也为个体甜味感知差异提供了分子依据。不同人群中的TAS1R2和TAS1R3基因变异,尤其是编码关键结合位点的单核苷酸多态性,显著影响对甜味分子的敏感度和喜好度。这不仅影响饮食行为,也关联部分人群的代谢健康状况。未来,通过精准医疗和营养基因组学,基于个体差异优化甜味剂的使用,有望实现更加个性化的味觉调节与健康管理。
技术上,本次结构解析采用了高度纯化的受体异源二聚体样品,结合冷冻电镜多角度成像和三维重构技术,成功克服蛋白质大型复杂弛豫性的难题,达到了约3埃的分辨率。数据处理流程中结合了人工智能辅助的粒子拾取和深度学习增强方法,显著提高了结构重构的质量与效率。后续基于结构的分子动力学模拟细致描绘了甜味分子在结合口袋的稳定性和动态变化,为机理研究增加了时间维度的洞察。 通过这些多学科融合的研究方法,此次对人类甜味受体的结构与功能解析不仅填补了味觉科学重要空白,也推动了生物医药领域和食品科技的跨界发展。展望未来,更高分辨率的动态结构解析和受体与G蛋白复合物的捕获将有望揭示信号传递的全过程,有助于全面认识甜味受体的生理和病理角色。 总体而言,人类甜味受体的结构功能研究已从基础的味觉感知扩展至代谢调控和疾病关联,成为融合结构生物学、分子药理学和个性化营养学的重要交叉学科领域。
深入挖掘这一受体的调控机制,不仅能指导甜味剂和相关药物的研发,还对促进健康饮食、预防代谢疾病有长远意义。科学家们正持续探索其更深层次的分子机制,期待未来甜味感知与代谢调控领域迎来更多突破,造福大众健康。