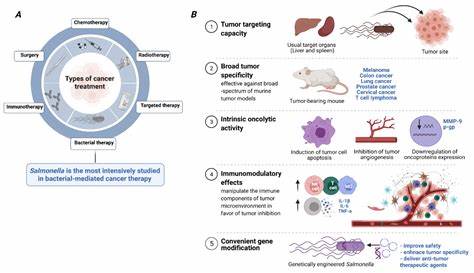
结直肠癌是全球范围内发病率和死亡率极高的恶性肿瘤类型之一,传统治疗方法如手术切除、放疗和化疗在部分患者中效果有限,且肿瘤的免疫逃逸机制使得现有免疫治疗手段往往未能取得理想疗效。针对这一问题,科研团队致力于开发更具针对性与有效性的治疗策略。近期,新加坡国立大学医学院与中国中南大学的科学家合作,成功开发出一种经过工程改造的沙门氏菌,通过精准靶向肠癌肿瘤内部并诱发强烈的免疫反应,为肠癌治疗带来了新的突破。该研究成果已发表在《科学转化医学》期刊,受到医学界广泛关注。 该研究的核心创新点是借助经弱化处理的沙门氏菌(Salmonella typhimurium)天然趋向肿瘤组织的特性,通过基因工程技术植入同步裂解回路(Synchronized Lysis Circuit,简称SLC)。当细菌聚集到一定密度时,触发这一回路使得沙门氏菌群体在肿瘤内部同步自我裂解,释放出预先设计的免疫激活蛋白 - - LIGHT。
这种蛋白可以与免疫细胞上的HVEM受体结合,激活一系列免疫信号,最终激发体内有效的抗肿瘤免疫反应。 结直肠癌肿瘤微环境复杂且具有免疫抑制性质,限制了许多免疫疗法的成功。此次研究重点揭示了通过 LIGHT-HVEM 信号通路激活固有免疫细胞群中的3型固有淋巴细胞(group 3 innate lymphoid cells, ILC3s)能够有效促进肿瘤附近形成和成熟"三级淋巴结构"(mature tertiary lymphoid structures, mTLSs)的过程。mTLSs是一种具有高组织结构和多种免疫细胞分布的免疫聚集区,已被证明与癌症患者更优异的生存率密切相关。通过重塑肿瘤微环境,mTLSs能够成为肿瘤免疫反应的"免疫中枢",增强肿瘤免疫系统的识别和杀伤能力。 与普通沙门氏菌仅能诱导肿瘤区域有限数量的三级淋巴结构相比,工程改造的沙门氏菌释放LIGHT蛋白后,不仅增加了mTLSs的数量,更重要的是促进其成熟,形成包含有功能分区的B细胞和T细胞区域。
这种组织结构的提升反映出肿瘤内免疫环境显著改变,提升了免疫细胞的协调作战水平。研究发现,mTLSs的这些免疫细胞尤其是CD8+杀伤性T细胞,其激活程度明显提高,产生出大量的干扰素-γ(IFN-γ)以及颗粒酶B,增强了肿瘤细胞的凋亡与清除。 在小鼠模型上,该团队分别实施了遗传易感模型和化学诱导模型,证明了该治疗策略能有效逆转肿瘤微环境中ILC3向ILC1的有害转化过程,维持肠道免疫屏障的活性和功能,降低促进肿瘤生长的免疫抑制状态。经过治疗的小鼠肿瘤体积显著缩小,多数动物的生存时间显著延长,甚至部分个体实现了肿瘤完全控制。进一步的功能验证显示,如若敲除HVEM受体或缺乏ILC3细胞,治疗效果无显著提升,表明LIGHT-HVEM信号轴与ILC3细胞在治疗机制中发挥关键作用。 需要指出的是,尽管小鼠模型中取得了令人鼓舞的实验结果,此项技术仍处于早期阶段。
从动物到人类的免疫系统存在诸多复杂差异,人类肠道菌群和免疫微环境的多样性可能影响治疗效果。此外,活菌治疗存在潜在感染风险,免疫激活过度可能引发炎症反应,且工程菌裂解释放多种分子成分,其中特异作用于肿瘤控制的关键因子尚需细致剖析。科学家们正在着力解决其安全性、稳定性及疗效特异性问题,为未来进入临床试验做准备。 该研究代表了合成生物学和肿瘤免疫治疗融合的新兴前沿,以"活体药物"(living medicine)的形式重新定义肿瘤治疗策略。工程化沙门氏菌能够精准定位肿瘤,对局部进行免疫调节,避免了传统免疫疗法全身激活带来的副作用。与此同时,将其与现有免疫检查点抑制剂、肿瘤疫苗等联合使用,有望显著增强肿瘤"免疫可见性"与治疗回应率。
未来,这一平台技术还可能扩展至肺癌、乳腺癌等其他实体瘤,通过定制不同的免疫激活因子,实现多元化的个性化治疗方案。 科学家们希望,随着该技术的不断优化,早日实现安全性与疗效的双重保障,将肿瘤靶向工程菌疗法推向临床,造福更多肠癌患者。通过精准免疫激活,"活体工程菌"有望成为癌症治疗领域的新革命,突破传统治疗瓶颈,提高患者生存率和生活质量。展望未来,合成生物学与肿瘤免疫学的深度融合将开辟更多创新路径,推动肿瘤治疗进入全新时代。 。