近年来,基因与神经科学领域取得了许多令人振奋的进展,尤其是关于调节生物体昼夜节律的“时钟基因”(CLOCK gene),其作用远超传统意义上的时间节律调控。来自德州大学西南医学中心的研究团队通过最新的实验技术发现,人类特有的CLOCK基因不仅调控睡眠和觉醒周期,还大幅提升了大脑的神经连接性和认知灵活性,尤其是在新皮层这一支持高级认知功能的重要区域。这一发现不仅揭示了人脑进化中的基因机制,更为治疗神经认知障碍提供潜在线索。上午与夜晚交替的生理节律,是生命体普遍具备的重要机制,CLOCK基因作为核心分子在调节这种内在24小时周期中扮演关键角色。早期研究将其功能局限于生物钟设置中,而最新的科研表明,CLOCK基因在人脑新皮层中展现出与昼夜节律无关的独特表达模式,这种差异在非人类灵长类动物的神经细胞中尚未被观察到,暗示该基因在进化过程中获得了新功能。为了深入探究人类CLOCK基因在大脑功能中的特殊作用,研究人员利用基因工程技术,构建了“人源化CLOCK基因小鼠”模型,即将人类CLOCK基因及其调控序列植入小鼠大脑。
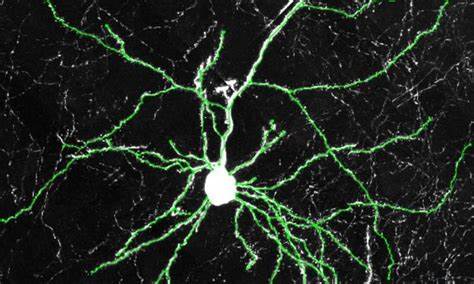
这一创新设计使得小鼠脑内该基因的表达模式高度逼近人类新皮层,从而为研究其具体影响提供理想的动物平台。行为学实验发现,这些“人源化”小鼠在普通学习与记忆测试中表现与正常小鼠无显著差异,但在涉及更高认知水平的认知灵活性——如规则转换任务中,表现出了明显优势。认知灵活性被认为是决策制定、问题解决和适应环境变化等复杂脑功能的基础,体现了大脑神经网络的高度整合与重组能力。进一步的组织学和分子生物学分析揭示,人类CLOCK基因在人源化小鼠新皮层兴奋性神经元中,促进了更多树突的形成及其分支复杂度的增加。树突是神经元接收信号的主要结构,树突的增多和复杂化意味着神经元与其他细胞的连接更加丰富,这一变化为大脑建立更高效的信息传递网络奠定基础。电生理记录也显示,树突的增强伴随着突触活性的提升,支持了更强的神经信号传导和处理能力。
细胞成分的变化同样显著,除了神经元数量增加,支持神经元功能的胶质细胞密度也明显上升,表明CLOCK基因可能促进神经发生与神经网络的整体发育。这些变化主要集中在人源化小鼠的大脑额叶皮层区域,该区域负责执行功能和高级认知活动,是理解认知灵活性提高的关键区域。单细胞RNA测序技术帮助研究团队识别了CLOCK调控下的基因表达谱,发现该基因在调控多种非昼夜节律相关的基因中发挥作用,影响神经元的代谢、信号传导与突触重塑等多方面过程。为验证发现在人类细胞中的适用性,研究人员利用CRISPR基因编辑技术,对人类诱导多能干细胞(iPSC)进行了CLOCK基因敲除实验。结果显示,缺失CLOCK基因的神经元显示出树突分支减少和突触密度下降,进一步印证了该基因促进新皮层神经网络复杂化的功能。这项研究不仅首次明确了CLOCK基因在人类脑进化中获得的新功能,也首次制备了能够模拟人类CLOCK基因表达的小鼠模型,为未来深入研究该基因的神经学机制提供了宝贵工具。
研究负责人Genevieve Konopka教授指出,CLOCK基因的研究打破了其仅作为生物钟调节因子的传统认知,显示其在人类高级认知功能塑造中的独特地位。人类大脑较其他灵长类动物拥有更大皮层面积和更复杂神经网络,这与CLOCK基因在新皮层高表达及其调控网络息息相关。未来研究将继续聚焦于CLOCK基因在人类胚胎阶段神经干细胞的功能,探索其对神经生成和神经网络发育的潜在影响。同时,探索CLOCK基因异常与认知功能障碍之间的联系,也有望为阿尔茨海默病、抑郁症等神经精神疾病提供新的治疗靶点。除了基本科学意义,这一发现还激发了科学界对于节律基因额外功能的广泛兴趣。过去认为调节行为节律的基因,可能同时参与各类神经系统调控过程,为未来揭示神经系统疾病的遗传基础及治疗方法指明方向。
综合来看,CLOCK基因在人类大脑中的特殊表达与功能突破,加深了我们对人类认知进化的理解,揭示了基因表达调控与脑功能复杂性之间的密切联系。揭示基因在认知灵活性中的角色,不仅丰厚了基础神经科学领域的知识体系,也为个性化医疗、脑疾病干预提供了新的视角。六字真言中“时”字基因,今朝正以其多维度神经调控作用,塑造出人类卓越的大脑机能,未来人类脑科学的探索旅程,必将伴随着对这一基因更深层的认识和开拓不断向前。