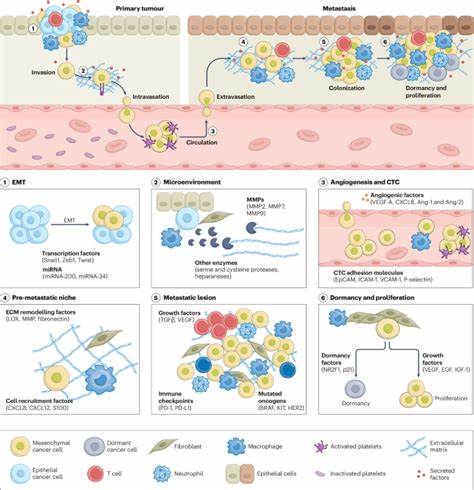
癌症转移是当前肿瘤治疗面临的最大难题。虽然许多癌症在发现时是局部原发肿瘤,但绝大多数癌症死亡是由远处转移性病灶引起的。转移过程包括癌细胞的侵袭、血管内侵入、循环、在新部位的止血和殖民等复杂步骤。每一步都涉及多重细胞与分子机制,为有效干预提供了多样化的目标。然而,传统的化疗和靶向治疗对转移性肿瘤的治疗效果有限,部分原因在于药物难以有效抵达和杀灭分散的小转移灶。面对这一挑战,纳米医学成为推动癌症转移治疗革命的重要工具。
纳米医学利用纳米尺度载体实现药物的精准递送,增强药物在肿瘤及其转移灶中的富集,降低对正常组织的毒副作用。肿瘤和转移病灶因血管异常和淋巴管重构产生的"增强渗透和滞留效应"(EPR效应)使得纳米颗粒可以被动积累。然而,转移灶的血管通透性与原发肿瘤存在差异,且癌细胞在转移过程中展现出更强的异质性和适应性。因此,科研人员通过设计不同功能化的纳米载体,旨在突破被动靶向的局限性,提升治疗效果。主动靶向技术是纳米医学发展的重要方向之一。通过在纳米颗粒表面连接肿瘤细胞表面特异性结合的配体,如抗体、寡核苷酸适配体或小分子配体,能够识别转移癌细胞独特的标志物,实现高度选择性的药物递送。
这类主动靶向不仅能增加纳米药物对转移微灶的黏附和摄取,还可以通过靶向癌细胞内特定信号通路,抑制癌细胞侵袭和迁移能力,阻断转移流程。纳米载体的智能设计使其具备响应肿瘤微环境的能力。例如,基于肿瘤组织酸性、酶类(如基质金属蛋白酶)活性、还原环境等特征,纳米药物能够实现刺激响应释放。此类设计保证了药物在非肿瘤部位封闭,而在转移病灶处精准释放,极大提升治疗的针对性和安全性。此类智能"开关"技术在对抗微小转移灶及微环境调节中发挥关键作用。转移肿瘤的微环境是纳米医学设计的重要考虑因素。
转移癌细胞与周围成纤维细胞、免疫细胞、血管内皮细胞及细胞外基质相互作用,形成独特的生态系统。科学家们借助纳米技术对肿瘤微环境进行调控,破坏支持转移的"助推轮",如抑制血管新生、调节免疫抑制状态、降解致密纤维网络,促进药物穿透和免疫细胞浸润。这不仅提高药物疗效,还增强免疫系统对转移瘤的攻击能力。纳米技术在RNA干扰和基因治疗领域同样获得突破性进展。将siRNA、miRNA或mRNA等核酸药物封装于纳米载体中,能够特异性沉默或调控关键的转移相关基因,改变癌细胞的表型和功能。例如,干扰上皮-间质转化(EMT)信号路径,抑制癌细胞迁移和侵袭,减少转移潜能。
此外,纳米载体保障核酸药物的体内稳定与细胞内高效递送,提高治疗持久性和精确度。组合疗法是攻克肿瘤转移的重要策略。纳米医学的发展使得多药物共载得以实现,不同的药物作用机制协同发挥,例如化疗药物和免疫调节剂的联合递送,增强肿瘤免疫反应并克服药物耐药性。同时,纳米颗粒可与光热、放疗和免疫检查点抑制剂等治疗手段组合,通过多模态杀伤实现转移瘤的综合控制。临床试验中已有数款纳米药物获批用于治疗多种癌症,其中部分展示了对转移病灶的有效控制。随着对纳米药物与转移肿瘤微环境复杂交互机制理解的加深,下一代纳米载体设计更注重患者个体差异和病灶异质性,实现精准医疗。
合适的患者分层和预后标志物的选取成为推动临床转化的关键。研究中还利用多种体外及体内模型,模拟转移癌微环境,评估纳米药物在转移癌中的靶向性和疗效。包括3D肿瘤球体、器官芯片模型及转基因小鼠模型,均为揭示药物作用机制提供了强大工具。同时,先进的成像技术帮助实时跟踪纳米药物的体内动态分布,为剂量和给药方案优化提供依据。未来发展方向涵盖智能纳米系统的进一步优化,增强针对肿瘤微血管和转移细胞的识别能力。融合人工智能和机器学习技术对纳米药物设计和患者筛选进行支持,提升治疗个性化和效果预测。
新型生物可降解材料和多功能纳米颗粒的应用将提升生物相容性和治疗安全性。纳米免疫治疗作为抗转移的新兴热点受到广泛关注。通过纳米载体递送肿瘤抗原、免疫激活剂或调节免疫抑制因子,可激活体内特异性免疫反应,清除转移性癌细胞。此类策略与免疫检查点抑制剂联用,展现出显著的协同增效,推动转移癌免疫治疗迈向新阶段。综上所述,纳米医学在对抗癌症转移中展现出无可比拟的优势。其不仅实现药物的精准定位和释放,还能调控复杂的转移微环境,激活免疫系统并结合多种治疗方式,为转移性癌症带来更有效的治疗方案。
随着研究的不断深入及技术革新,纳米医学必将在未来癌症转移治疗中发挥越来越重要的作用,为患者带来新的生机和希望。 。