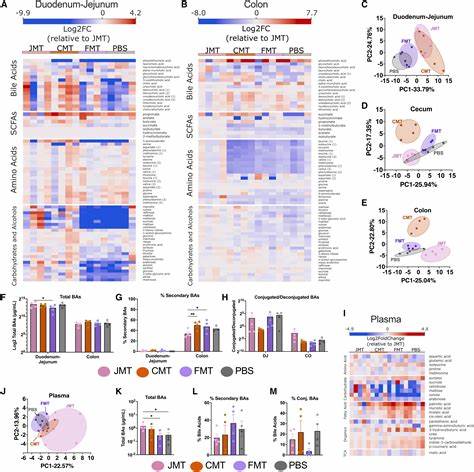
随着对肠道微生物组研究的深入,人体肠道内的不同区域存在截然不同的微生物生态系统,这种区域特异性在维护宿主健康和代谢平衡中发挥着重要的作用。微生物组移植,特别是粪便微生物移植(FMT),已经成为治疗多种肠道疾病的重要手段,尤其是在复发性艰难梭菌感染中的应用取得显著疗效。然而,最新研究表明,传统FMT主要基于大肠厌氧微生物组成,这些微生物若移植至小肠等非原位区域,会导致微生物与宿主局部环境的失配,从而引发一系列非预期的代谢和免疫效应。不同区域的肠道生态具有独特的物理化学条件和组织结构。小肠作为主要的营养消化和吸收部位,拥有丰富的胰酶、胆汁分泌和薄层黏液覆盖,偏向需氧或兼性厌氧菌群。而大肠则是一个高度厌氧的环境,有丰富的短链脂肪酸(SCFAs)、复杂多糖及其降解产物,这里微生物多样性和代谢活动与小肠截然不同。
由于这种区域性的差异,微生物群的功能也各不相同。例如,小肠微生物更直接影响脂质消化、胆汁酸代谢以及宿主能量平衡,而大肠微生物则更侧重于发酵复杂碳水化合物,产出SCFAs调节免疫和肠道健康。当传统以大肠微生物为基础的FMT移植到小肠时,这些非本地厌氧微生物的入侵导致区域生态系统的改变。研究发现,接受FMT的患者在小肠黏膜中存在着大量来自大肠的厌氧菌持续定植,打破了小肠原有的氧化还原环境和微生态平衡。这种失配不仅影响微生物群落结构,也重塑了宿主肠道组织的转录组,尤其是调节肠道区域身份的关键转录因子,如小肠特异性的Gata4和Gata6,以及结肠特异性的Satb2表达发生了明显变化。这表明微生物不仅被宿主环境选择,还能反向影响宿主肠道组织的基因表达,促进非本地微生物的适应性生存。
功能上,小肠微生物移植(JMT)倾向于激活宿主的脂质代谢和能量储存途径,表现为受体体重增加及能量消耗降低。而FMT(主要含厌氧大肠微生物)则更显著地激活宿主免疫相关基因,诱导多种炎症信号通路,可能导致肠道免疫功能异常。体内外多组学分析表明,这些移植失配不仅局限于肠道局部,还波及到肝脏等远端器官,引起代谢组和肝脏转录组的长时间改变。这种改变进一步导致脂肪酸氧化水平和胆汁酸组成的变化,影响系统性代谢稳态,可能导致不良的代谢和免疫后果。动物模型中,经过抗生素屏障处理的小鼠与无菌小鼠均显示出不同移植组之间微生物定植的差异及其对宿主代谢的多层次影响,证实了微生物与宿主生态的动态互动。此外,人体肠道类器官实验也验证了微生物移植的地域性特性,可快速诱导宿主组织的代谢及身份相关基因表达变化。
临床观察中,FMT带来的小肠厌氧菌增多与体重变化、免疫系统反应等现象相关,提示这些非靶向效应可能在实际治疗中贡献于疗效波动或副作用产生。综合现有证据,研究者呼吁未来的微生物治疗策略应重视肠道的区域微生态差异,设计包含小肠及大肠原生微生物的复合移植方案,或开发针对特定区域生态优化的全肠道微生物移植(OMT)。同时,移植途径选择(如结肠镜vs.口服上消化道途径)也应权衡以减轻潜在的非靶向影响。除微生物组本身,宿主肠道组织的适应性改变也不容忽视。长期的微生物失配可能导致肠道上皮细胞的“身份转换”或偏离原有区域特性,这种转分化现象虽不完全,但对肠道功能及宿主代谢产生深远影响。未来工作需探明具体介导这些效应的微生物群及其代谢产物,揭示分子机制并寻找可控的调节手段。
亦有必要深入研究FMT后长期的临床表现,追踪代谢病、免疫病甚至神经系统疾病的发展风险,为精准微生物治疗树立安全评估标准。微生物组移植作为一种潜力巨大的治疗工具,其成功依赖于对肠道区域性微生态和宿主相互作用的精准把握。现有研究证明,忽视肠道区域微生物差异和宿主环境对移植微生物的适宜性评估,将可能带来非靶向、潜在有害的代谢及免疫后果。这一发现推动肠道微生物治疗从“统一方案”向“定制区域兼容型方案”转变,提升治疗有效性并降低风险。未来微生物组科学结合高通量组学、动物模型和临床样本的多维度整合,将揭示更精细的微生物—宿主交互图谱,促进新一代基于区域匹配的微生物干预策略的开发。随着医学界对肠道微生态复杂性认知加深,确保合理的微生物移植设计成为保障患者安全与疗效的关键前提。
对广大科研人员和临床医师而言,深入理解肠道区域性微生物生态及其与宿主代谢免疫的联动关系,是有效开展微生物治疗新突破的基石。