在全球范围内,艾滋病病毒(HIV)依然是威胁公共健康的严峻挑战。尽管抗逆转录病毒疗法(ART)能够有效抑制病毒活动,降低病毒载量,但无法清除体内存在的潜伏病毒库。尤其是静息CD4+ T细胞内潜伏的HIV基因组以转录沉默的状态存活,成为完全根除病毒的最大障碍。面对这一难题,科学家们不断探索能够有效逆转这种潜伏状态的策略,而高效的mRNA递送技术则展现出令人振奋的潜力。mRNA作为基因信息的传递载体,能够在细胞内表达多种功能蛋白,应用于唤醒潜伏HIV的转录活性,促使病毒表达并实现免疫系统的识别和清除。然而,静息的CD4+ T细胞因其代谢和转录低活性,向其递送mRNA存在着极大的技术挑战。
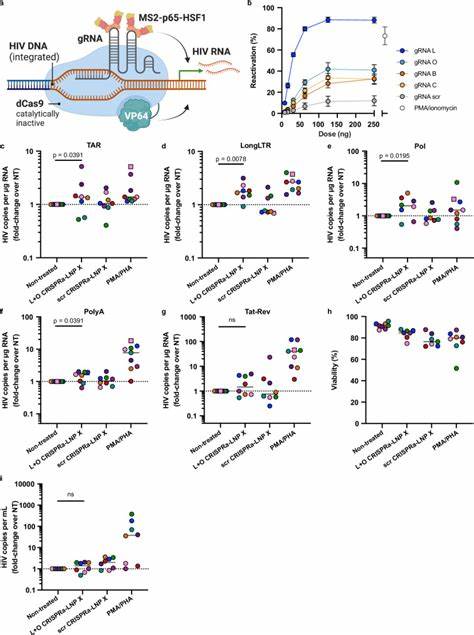
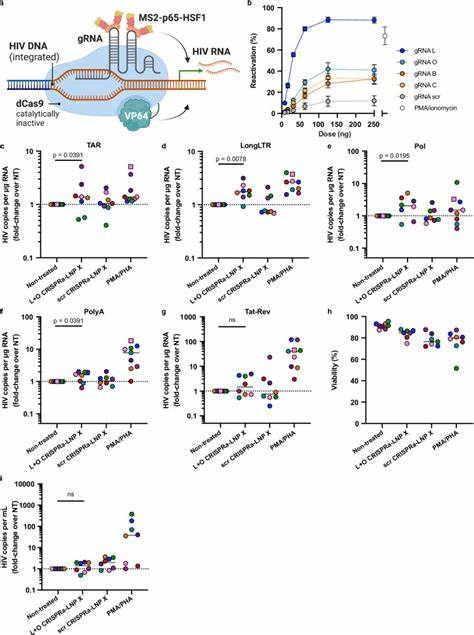
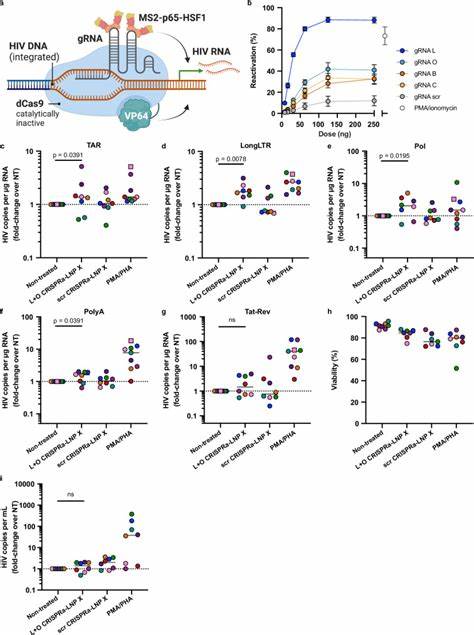
以往的基因递送手段大多依赖细胞预激活才能提高转染效率,但这通常伴随着细胞功能的改变和潜在的毒性问题。近年科研团队设计了一种全新的脂质纳米颗粒配方,称为LNP X,它以SM-102为核心的离子化脂质并用β-谷甾醇替代传统胆固醇,显著提升了纳米颗粒与静息T细胞的结合力和mRNA的翻译效率。这种LNP X不仅实现了无需预激活即可高效转染超过75%的静息CD4+ T细胞,还大幅降低了细胞毒性,保持了细胞的生理状态和功能完整性。该技术突破传统脂质纳米颗粒在免疫细胞转染上的限制,为精准基因治疗奠定了基础。利用LNP X递送编码HIV转录激活因子Tat的小型mRNA,有效唤醒了携带潜伏病毒的静息T细胞,使病毒转录达到甚至超过传统强刺激剂(如PMA/PHA)的效果。Tat蛋白通过结合远端的转录响应元素(TAR),促进RNA聚合酶II的转录延伸,从而克服了潜伏期病毒存在的转录延迟和截断问题。
这种特异性激活大大降低了非特异性细胞激活的风险,避免了潜在的系统性炎症反应,同时诱导了病毒的蛋白表达和释放,为免疫介导的清除创造了机会。除Tat mRNA外,LNP X也成功共递送了更复杂的CRISPR激活系统(CRISPRa),包括编码无活性的Cas9蛋白与多重转录激活域的mRNA及导向RNA。CRISPRa通过定位到HIV长末端重复序列(LTR)启动子区域,精准激活病毒转录,实现了更高的激活特异性和潜在的安全性。初步的体外及外周血单个核细胞试验均显示,CRISPRa-LNP X能有效促进潜伏HIV转录但不引起细胞广泛激活,提示其作为下一代潜伏逆转剂的巨大前景。尽管Tat-LNP X在激活潜伏病毒方面表现突出,但病毒表达的唤醒并未直接导致储存库中整合病毒数量的显著减少,说明潜伏细胞可能具备较强的抗凋亡能力。未来研究需结合增强细胞毒性效应如BCL-2拮抗剂,或免疫增强疗法进一步提升清除效率。
同时,针对不同HIV亚型及深度沉默细胞的广谱作用也需深入探讨。此项研究不仅揭示了mRNA-LNP技术对静息T细胞的高效递送机制,还提出了脂质组分中β-谷甾醇可能通过增加粒子与细胞的结合及胞质内mRNA转译效率而提升整体转染效果的新见解。相比以往依赖肽或病毒载体的基因转染方式,基于LNP的非病毒载体具备安全性高、可控性强及制备成本低的优势,符合未来临床应用的需求。此外,LNP X对多种免疫细胞亚群均具有转染能力,显示出广泛的细胞适用性,助力多种基于mRNA的免疫疗法研发。展望未来,如何将LNP X技术从体外实验推向体内应用,解决体内稳定性、靶向性和免疫原性问题,是实现临床转化的关键。通过表面修饰实现纳米颗粒特异性靶向CD4+ T细胞,减少非靶细胞吸收,提升治疗精准性,将极大增强治疗效果和安全性。
同时,结合实时监测和剂量优化,能够为潜伏病毒完全清除奠定坚实基础。总结而言,创新mRNA递送科技,特别是基于脂质纳米颗粒的LNP X配方,为打破HIV潜伏感染的瓶颈带来了革命性突破。它不仅实现了对静息T细胞的高效、低毒递送,同时赋予了激活潜伏病毒的强大能力。通过联合CRISPRa基因调控系统,未来有望实现更为精准和个性化的抗病毒策略。虽然临床应用尚需进一步研究和优化,但毫无疑问,这一技术的成功研发为实现功能性治愈甚至根治HIV带来了前所未有的新希望。随着mRNA药物及基因编辑工具的快速进展,依托安全高效的递送系统,艾滋病毒治疗正在迈向一个全新的时代,多个潜资深难题也必将在技术创新的驱动下逐步被攻克。
。