阿尔茨海默病作为一种慢性神经退行性疾病,严重影响了全球数千万患者及其家庭的生活质量。当前虽有多种治疗手段,但真正能够延缓病情进展并显著改善认知功能的药物仍然有限。因此,科学家们不断探索新的预防和治疗策略,其中锂元素的研究近年来取得了令人瞩目的进展。 锂作为一种广泛应用于电池制造的金属,拥有独特的电化学性质。它不仅支撑着现代电子设备的运转,更被发现在人体神经系统中可能发挥着特殊作用。早在20世纪70年代,锂碳酸盐被美国食品药品监督管理局(FDA)批准用于治疗双相情感障碍。
尽管锂在精神疾病治疗中的应用历史悠久,但其在神经保护,尤其是阿尔茨海默病中的潜在功效一直未被充分认识。 此前的临床随机对照试验虽然规模偏小,但均不同程度地证明了锂对认知功能的积极影响。例如,多项临床试验显示,低剂量锂治疗能够延缓轻度认知障碍患者向阿尔茨海默病转变的进程。同时,这些试验揭示锂有助于促进脑脊液中淀粉样β蛋白的清除,这种蛋白质积累正是阿尔茨海默病病理表现的关键之一。 除了临床试验外,流行病学研究同样提供了有力的佐证。丹麦一项涵盖近五千名双相情感障碍患者的研究指出,接受锂治疗的群体在发生痴呆症的风险上明显低于未接受锂治疗者。
这种保护效应在调整其他药物影响后依然显著。此外,利用饮用水中锂含量的地理差异,相关研究发现生活在高锂水区的人群罹患痴呆症的风险更低,提示锂在日常微量摄取中发挥潜在神经保护作用。 最新发表于《自然》杂志的一项研究对人脑中多种金属元素进行了系统测量,结果唯有锂的浓度显示出与认知状态的显著相关性。研究发现,认知正常个体脑组织中的锂含量明显高于轻度认知障碍及阿尔茨海默病患者。此外,锂在大脑皮层与血液中的分布比例存在较大差异,且锂的脑内水平远低于双相情感障碍治疗中所使用的剂量。 实验动物模型的研究进一步加深了对锂神经保护机制的理解。
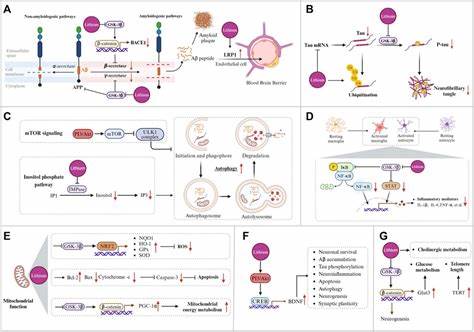
在阿尔茨海默病小鼠模型中,锂缺乏饮食导致炎症反应加剧,淀粉样蛋白及磷酸化tau蛋白显著积累,突触和神经纤维受损,认知功能显著下降。相反,补充锂则有效缓解了这些病理变化。 尤其值得关注的是,科学家发现不同锂盐对认知保护的效果存在差异。常用的锂碳酸盐容易被淀粉样蛋白截留,从而降低其有效性。相比之下,锂氧化物盐表现出较强的避免被蛋白质截留能力,能够更有效地促进脑内免疫细胞微胶质的清除功能,减轻神经炎症,减少淀粉样蛋白及tau蛋白的沉积。 此外,锂或otate盐甚至被证实能够恢复老年健康小鼠的记忆性能至年轻水平。
这一发现暗示锂不仅能够减缓疾病进展,还具备逆转部分认知衰退的潜力。 从分子机制角度出发,锂通过抑制糖原合酶激酶3β(GSK3β)这一关键酶类的活性,发挥其神经保护作用。GSK3β在阿尔茨海默病的病理进展中扮演重要角色,介导tau蛋白的异常磷酸化和神经元凋亡。锂的抑制作用有助于减少这些异常病理过程,从而减轻神经系统损伤。 尽管研究成果喜人,锂在阿尔茨海默病的临床应用仍存在挑战。锂碳酸盐因治疗双相情感障碍所需的高剂量带来多种副作用,包括神经系统、肾脏和甲状腺功能损害,限制了其在阿尔茨海默病中的广泛使用。
幸运的是,新研究显示低剂量锂,尤其是锂氧化物盐,可能安全且有效,避免了高剂量带来的风险。 目前,科学界呼吁进行更大规模、多中心、长期的随机对照临床试验,以验证低剂量锂或锂氧化物盐在阿尔茨海默病预防及治疗中的效果和安全性。同时,也倡导利用现代生物标志物,如血液中的磷酸化tau蛋白(p-tau217)及其他神经炎症指标,来评估锂治疗的疗效和疾病进展。 未来,锂的临床研究或将拓展至其他神经退行性疾病,如帕金森病等,因其减轻神经炎症、促进病理蛋白清除的机制具有广泛适用性。此外,对人体内锂水平作为神经退行性疾病风险预测指标的研究也逐渐展开,预示着锂将在个性化预防医学领域扮演重要角色。 总结而言,锂元素作为一种古老而又现代的金属,在阿尔茨海默病研究领域掀起了新的希望浪潮。
其独特的神经保护功能、促进淀粉样蛋白清除和调节炎症反应的能力,为疾病的早期干预和治疗提供了新思路。现有的临床证据与动物实验结果均表明,适量的锂补充可能有效延缓认知衰退,保护脑功能,但必须以科学严谨的临床试验为依托,确保其安全性与有效性。 随着科学技术进步和研究的深入,锂的神秘面纱逐渐揭开。未来,或许锂不仅仅是电子设备的重要组成部分,也将成为人类抗击阿尔茨海默病乃至其他神经退行性疾病的关键武器。推广科学的认知,合理规范锂的研究与应用,将为亿万患者带来福音,也为全球公共卫生事业贡献新的力量。 。