随着现代医学和营养学的发展,人们对肠道微生物群的重要性认识日益深化。肠道微生物群不仅参与散发出消化和吸收功能,更与人体免疫系统、代谢调节甚至神经功能密切相关。近年来,肠道微生物群的失衡(或称肠道菌群紊乱)被证实与多种疾病相关,例如肥胖、糖尿病、炎症性肠病以及感染性疾病。抗生素作为破坏肠道微生物群的常见因素,虽然能有效控制细菌感染,但常引发微生物多样性的降低和功能障碍。如何促进抗生素后肠道微生态的快速且健康恢复,成为重要研究课题。近期发表在《自然》杂志上的一项研究表明,饮食干预在恢复肠道微生物群生态中表现出显著的优势,远超普遍关注的粪菌移植疗法(FMT),为肠道微生态恢复带来新的希望。
该研究利用小鼠模型,深入分析了在高脂低纤维的西式饮食和普通饲料饮食两种条件下,肠道微生物对抗生素治疗后的反应差异,揭示了饮食成分对微生物群生态位构建、功能合作关系和抵抗致病菌入侵的关键影响。研究发现,西式饮食喂养小鼠表现出肠道微生物群的多样性和功能广度显著下降,这种微生物群植根于有限的资源,导致某些优势菌占据生态位并缺乏产生多样代谢产物的协作过程。这种生态结构不仅妨碍了微生物群的快速恢复,还使得肠道易受致病菌入侵,尤其是沙门氏菌的感染风险显著提升。相反,普通饮食(富含纤维和多样碳水化合物)为肠道微生物提供了丰富且多样的营养资源,促进了微生物种间复杂的代谢互助和交叉喂养过程。这样的协作关系加速了菌群的恢复,提升了微生物功能的多样性,并强化了肠道的抵抗力。研究通过代谢建模进一步揭示,普通饮食环境中微生物间频繁的物质交换和资源共享显著提升了生态系统的稳定性和生态恢复力。
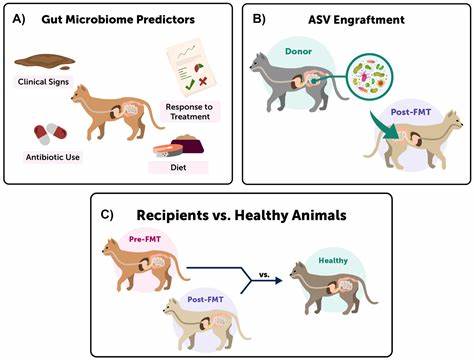
此外,实验中设置了饮食干预和粪菌移植的对比干预方案,结果显示单独的粪菌移植未能显著促进肠道微生物群的全面恢复,而只要给与适宜的饮食环境,微生物群的多样性和功能就能迅速恢复。饮食干预既是快速恢复的必要条件,也是实现有效粪菌移植的前提,为未来临床应用提供了新的思路。除恢复速度和功能表现外,饮食对肠道微生物群的恢复还影响宿主的免疫状态和肠道屏障功能。研究团队发现,长期维持西式饮食的小鼠尽管接受粪菌移植和抗生素治疗,依然表现出对致病菌沙门氏菌的高敏感性,体重下降和炎症发病风险增加。反之,普通饮食组小鼠能有效抵御感染,肠道炎症显著减少。这一发现强调饮食作为生态环境基础,对微生物群恢复的质量和宿主健康的决定性作用。
现有的肠道微生物群治疗中,粪菌移植被广泛应用于治疗艰难梭菌感染等疾病,但其安全性和效果存在一定争议。部分患者因基础饮食结构不当,导致微生物群无法有效定植,甚至诱发再次感染的风险。此次研究结果提示,临床实践中应重点关注患者的饮食调整,确保提供多样且富含微生物可利用碳源的营养基础,这样不仅提高微生物移植的成功率,也有望避免因微生物群植入失败而带来的副作用。基于此,未来肠道微生态的干预策略应转向整体生态环境塑造,综合饮食管理与精准微生物疗法相结合,从而实现生态系统的自然恢复和功能重建。科学家们还发现丰富的膳食纤维能够显著降低抗生素引起的肠道氧化应激,调节肠道的氧化还原潜势,维护菌群生态稳定。来源多样的碳水化合物不但促进了优势菌株之间的协同进化,也避免了单一优势菌株的过度繁殖形成生态孤岛,保证了生态系统功能的冗余性。
适宜的饮食模式像是为微生物群搭建了一个有机、交互丰富的“生态舞台”,使得不同的微生物种群能够找到各自生态位,在资源竞争和代谢协作中逐渐恢复多样性,并抵御环境的波动和病原菌扩散。该研究还通过基因组及代谢组分析,追踪了微生物群在恢复过程中关键代谢路径的变化,诸如短链脂肪酸的合成,复杂碳水化合物的分解代谢及能量代谢链路在普通饮食中恢复更为迅速和完整,这些代谢产物不仅给肠道上皮细胞提供能量,还调节宿主免疫反应,强化肠道屏障,降低炎症风险。科研团队期望这项成果推动未来微生物组治疗的创新,引导更多关注营养基础,推动形成“饮食为本,微生物为辅”的复合干预治疗体系。针对肠道病理和代谢疾病患者,结合个体饮食调整的微生物治疗方案或将成为标准化管理的新方向。当前,这项研究为众多肠道疾病的康复治疗提供了全新视角,也呼吁人们重视日常饮食对肠道生态的根本影响。特别是在抗生素广泛应用的现代社会,科学合理的饮食可作为天然、安全且高效的肠道生态恢复策略。
对广大读者而言,适当增加富含膳食纤维的天然食品摄入,不仅有助于保持体重和代谢健康,更为肠道微生物提供了稳定且多样的生存环境,防止菌群紊乱及相关疾病的发生。总结来看,这项关于饮食优于微生物移植驱动肠道微生物恢复的研究,强调了生态系统中资源多样性和营养支持在微生态恢复过程中的主导作用。它从宏观饮食到微观微生物互动,全面解析了肠道生态系统的自我修复能力,为未来肠道健康管理奠定了坚实基础。人们应在保持合理饮食结构的同时,科学使用抗生素及微生物疗法,实现肠道生态的动态平衡与长远健康。