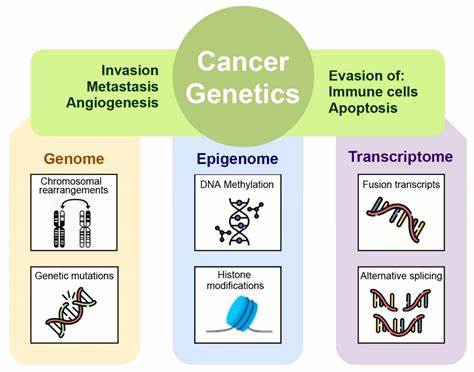
近年来,随着高通量测序技术的普及和单细胞组学的兴起,癌症作为一种"基因病"的传统观念逐渐暴露出难以解释的众多矛盾和问题。基于体细胞突变理论的癌症遗传学范式,即癌症肿瘤由单个突变细胞克隆扩展而来并逐步积累"驱动基因"突变,这一理论长久以来占据主导地位。然而,从肿瘤谱系分析、超高异质性、更广泛的非基因组异质性到基因突变在非癌变组织存在,均对这一范式提出了沉重质疑。基因范式面临的挑战不仅反映在数据层面,更涉及理论和哲学层面的广泛反思。肿瘤基因组测序揭示了常见肿瘤组织内存在成千上万个不同的克隆,多样性驳斥了严格的单克隆进化论。突变似乎更像是癌症复杂表型中的一个伴随现象,而非必然因果的唯一根源。
精准医疗所谓的针对驱动基因的药物常因肿瘤的继发耐药、复发及更加侵袭性过程而效果有限,进一步暴露了基因驱动模型的局限。传统基因范式忽视了细胞表型的可逆性和非遗传机制,难以充分解释治疗过程中的细胞"去分化"现象及癌细胞的高度适应性。此外,环境因素、组织微环境、细胞间相互作用及机械信号同样塑造癌症进展,构成肿瘤生态系统的重要组成部分。再者,经典的"癌症起源于单一突变细胞"论断,忽视了组织水平的相互关系和协同机制,未能解答为何存在携带大量"癌基因"突变的正常细胞却不发生癌变的科学谜题。回顾历史,早在分子遗传学盛行之前,科学家即观察到癌细胞可随着组织环境变化恢复正常,所谓的"癌症表型归一化",这是基因范式难以囊括的现象。这启示研究者们重新审视癌症的本质 - - 或许癌症系组织整体调控失衡之结果,而非单一基因层面的致病事件。
当代理论提出,细胞的表型由复杂的基因调控网络(GRN)决定,细胞状态的转变更多依赖于基因调控网络自身动态吸引子状态的改变,而非简单基因突变。Waddington的"表观遗传景观"理论形象地描绘了这一过程:细胞可视为在多极稳定态的基因表达空间中,健康与癌症状态分别对应于不同的吸引子。癌症为基因调控网络潜在的"失控"状态,可能在各种刺激如基因突变、环境变化或组织微环境紊乱干扰下被激活。此观点解释了为何许多不同突变均可引发类似癌症表型,突变更多是改变整体景观形态的因素,而非单独"癌基因"驱动。组织整体层面,组织组织场理论(TOFT)强调,癌症是组织耐受细胞默认增殖运动状态受到抑制功能丧失的表现。换言之,细胞的增殖和迁移为其默认状态,健康组织通过微环境抑制细胞失控,而癌症则为组织约束机制的失败。
大量实验数据印证了肿瘤微环境和基质细胞(成纤维细胞、免疫细胞等)对癌变进程的决定性影响。组织与细胞的相互作用不仅塑造正常发育,也调节或触发肿瘤发生。实验动物中,非癌细胞在癌症相关微环境下可恢复或变为恶性,反之亦然,体现组织对癌症发展关键性的全局调控作用。肿瘤不仅是基因组的"混乱",更是高度结构化的组织生态失衡结果,涉及细胞间交流、机械力学、细胞分化状态和相邻微环境的猛烈互动。理解癌症必须超越基因变异,综合考虑表型可塑性、基因调控复杂网络和组织层面的组织学动力学。现代研究倡导结合多尺度数据解析,建立数学和生物信息学模型,模拟基因调控网络的多态稳定态,量化肿瘤组织的动力学演化。
癌症再不是简单单细胞基因突变问题,而是一场多层次系统生物学的挑战。这种转变为癌症治疗开辟了更为丰富的视野,强调调控细胞命运轨迹、重塑组织微环境及解除细胞成熟阻滞的治疗策略。靶向单点突变的精准药物固然重要,但单一策略难以攻克癌症的复杂网络机制。强调组织稳态维护、促进细胞分化和重建正常组织微环境有望实现更持久有效的治疗效果。面对基因范式的终结,癌症研究重回理论生物学根基,唤醒对发展、生理与进化的深度思考,使癌症研究成为真正的人体整体学而非单一基因组学。展望未来,只有融合生物系统的多层次规律,探索基因与非遗传机制、细胞与组织间协同机制,才能突破困局,推进癌症诊断与治疗进步。
技术日新月异,数据爆炸如同达尔文当年"砾石堆积",唯有理论的指导与跨学科整合,方可洞悉癌症本质,开启真正的癌症治疗新时代。 。