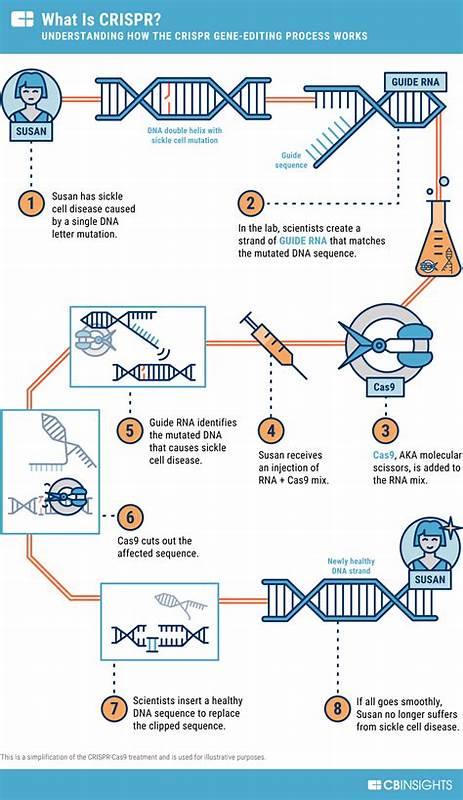
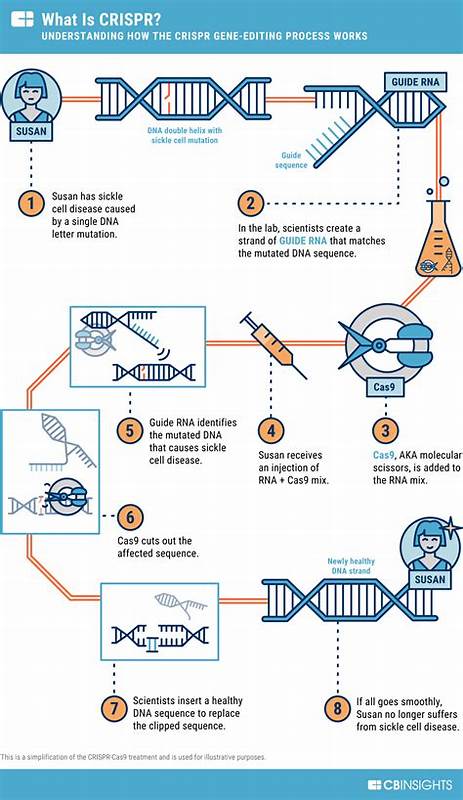
阿尔茨海默病长期被视为医学和社会的双重挑战。记忆衰退、认知障碍和功能丧失给患者与家庭带来沉重负担,而现有药物对疾病进程的影响有限。近几年,随着基因编辑技术CRISPR的发展,科学界开始认真思考通过编辑病理相关基因来改变阿尔茨海默病轨迹的可能性。基因层面的干预或许无法在短期内替代所有治疗手段,但为某些遗传性或特定风险人群提供根本性治疗带来了新的希望。 阿尔茨海默病的遗传学提示了基因干预的目标。阿尔茨海默病主要分为家族性早发型和散发性晚发型。
家族性病例通常与APP、PSEN1、PSEN2等致病突变直接相关,携带这些突变的人几乎必然在较早年龄发病。相比之下,散发性阿尔茨海默病受多基因和环境因素影响,其中APOE4等位基因是已知的最强遗传风险因子。APOE4携带者患病风险显著增加,而APOE2则具有保护作用。了解这些基因及其功能,为CRISPR提供了明确的靶点和策略。 CRISPR的基本原理相对简单但功能强大。以CRISPR-Cas9为代表,研究者利用向细胞内引入导向RNA和Cas蛋白,使其在基因组特定位点切割DNA,从而实现基因敲除、插入或替换。
近年来基于Cas的编辑工具不断扩展,包括碱基编辑(base editing)可以在不产生双链断裂的情况下实现单碱基替换,精确编辑(prime editing)则进一步提高了编辑灵活性,RNA靶向的Cas13能够在转录水平调控基因表达。多样化的编辑工具为不同病理机制提供了多种干预方式。 针对阿尔茨海默病的CRISPR策略主要可归为几类。其一,直接修复致病突变。对于携带APP或PSEN突变的家族性患者,利用碱基编辑或精确修复技术纠正致病等位基因,理论上可以阻断病程启动或延缓发病时间。其二,改变风险等位基因功能。
将高风险APOE4编辑为APOE3或APOE2的想法已在动物模型中得到探索,碱基编辑或剪切-替换策略可以实现功能性转换,从而降低风险。其三,降低有害蛋白表达或干预病理通路。针对产生β-淀粉样蛋白的关键酶或蛋白产物,通过CRISPR敲低BACE1或直接减少MAPT(tau蛋白编码基因)表达,可减少斑块或神经纤维缠结的生成。其四,增强清除与修复机制。提高神经元和小胶质细胞对异常蛋白的清除能力,或提升细胞自噬与蛋白质降解通路,亦是潜在方向。 现有研究已经在多种动物模型中展示出初步效果。
通过AAV介导的CRISPR系统在小鼠脑内降低APP或BACE1表达,观察到淀粉样病理和认知表现的改善;碱基编辑技术在转基因小鼠中修复有害等位基因,延缓了病理进展并改善行为学评分。这些成果为临床转化奠定了科学基础,但也暴露出技术与生物学的多重限制,需要谨慎评估。 递送是神经系统基因编辑面临的核心挑战之一。相比血液系统,脑组织的复杂性和血脑屏障使体内递送变得困难。常用载体包括腺相关病毒(AAV)、脂质纳米颗粒(LNP)、外泌体以及直接立体定向注射等。AAV载体具有高效转导神经细胞的优势,但存在载体容量有限、免疫原性和长期表达带来的不可逆性等问题。
LNP在肝脏应用上取得成功,但要跨越血脑屏障并实现广泛分布仍需优化。脑室内或脑实质注射能实现局部高效编辑,但侵入性高且难以覆盖广泛受累区域。如何在有效递送与安全性之间取得平衡,是从实验室到临床的关键瓶颈。 安全性问题不可忽视。脱靶效应可能引发非预期的基因突变,长期来看有致癌或其他严重后果的风险。Cas蛋白和载体本身可能诱发免疫反应,尤其是在体内递送时可能导致炎症加剧或编辑效率下降。
脑组织具有高度不可替代性,任何不当的编辑都可能带来不可逆的功能丧失。因此,严格的脱靶检测、更温和的编辑策略以及可控的时间窗口设计都是必要的前提。 临床目标的选择需要审慎。对于明确由单一致病突变导致的早发家族性阿尔茨海默病,基因编辑的风险收益比更容易被评估,患者群体相对集中,也更适合作为早期临床试验对象。对于散发性晚发患者,由于病因复杂、涉及多基因和环境因素,单一基因编辑可能效果有限,且人群异质性增加了临床试验设计的难度。因此未来临床试验可能优先面向带有致病突变或高度危险基因型的人群,同时结合生物标志物和影像学随访以评估治疗效果。
监管与伦理问题同样重要。基因编辑在大脑中引发的长期、不可逆影响要求监管机构制定更为严格的评估标准。伦理上需充分考虑患者的知情同意、风险沟通与长期随访责任。基因编辑的可遗传性问题在体内治疗中通常不构成干扰,但需要明确界定体外与体内编辑的界限,防止产生不受控的世代传播风险。 转化路径上,多模态治疗可能是更现实的路线。将基因编辑与抗体疗法、免疫调节、生活方式干预和早期诊断相结合,可以对不同阶段的阿尔茨海默病施以更有针对性的治疗。
基因编辑可负责纠正或降低长期风险,而药物与免疫疗法则可用以清除已形成的病理产物或缓解急性炎症。这样的组合策略更有望在临床上取得实用性成果。 目前的技术进展已经显示出临床可行性,但距离常规临床应用仍有显著距离。基础研究需要继续优化编辑工具的准确性和可控性,递送技术需要解决跨越血脑屏障、实现广泛且安全分布的难题,临床试验需要建立敏感的生物标志物和长期随访体系。与此同时,多学科合作、伦理审查与公众参与也必须同步推进,以确保技术发展符合医学与社会价值。 总结来看,CRISPR为阿尔茨海默病提供了前所未有的干预思路。
对特定遗传类型的患者,基因修复或等位基因转换有望带来根本性改变。对散发性病例,基因编辑可作为风险调控或辅助治疗手段融入更广泛的治疗组合中。现实的道路并非一帆风顺,但科学进展与监管框架的不断完善将逐步把基因编辑从实验室带入临床。对患者与公众而言,既要抱有合理期待,也要理解技术的局限与潜在风险。未来十年内,随着编辑工具和递送系统的成熟,CRISPR参与的阿尔茨海默病治疗有望从概念验证走向临床试验,从局部干预走向更安全、更有效的患者惠及途径。 。