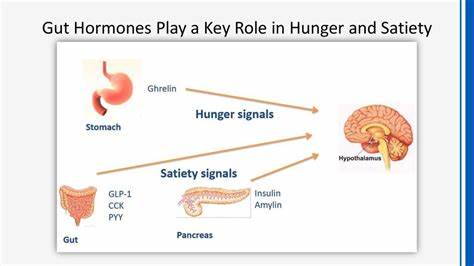
近年来,关于食物结构对人体消化及代谢影响的研究日益增多,越来越多的证据表明,食物的物理形态比其营养成分更能深刻影响肠道内激素的释放,进而调控血糖波动、胰岛素分泌以及进食后的饱腹感。这一发现不仅为营养学和食品科学带来了新的思路,也为防控肥胖、2型糖尿病等代谢疾病开辟了创新路径。 英国帝国理工学院与Quadram研究所近期开展的一项先锋性研究,首次通过对比不同结构的鹰嘴豆餐饮,揭示了食物的微观结构如何调节不同肠道激素的释放。研究采用健康成人志愿者为实验对象,通过在胃和小肠不同部位采集样本,结合血液检测与饥饿感评分,系统剖析了细胞完整性对代谢和激素反应的影响。 研究中所用的鹰嘴豆餐品具有相同的营养成分,但经过不同工艺处理,形成了“细胞完整团块”、“单独完整细胞”与“破碎细胞”三种结构。结果显示,破碎细胞结构的餐食导致血糖及胰岛素迅速升高,同时促使肠促胰岛素激素(GIP)大量释放。
相反,完整细胞结构的餐饮则使胰高血糖素样肽-1(GLP-1)和肽YY(PYY)等饱腹感激素的释放时间延长,从而显著提升了食用后的饱腹感和满意度。 这背后的机制与食物在胃肠道中的消化位置密切相关。GIP主要由小肠上段的K细胞分泌,当食物结构被破坏时,其较快释放的葡萄糖等代谢产物迅速刺激这些部位,激活GIP分泌。而GLP-1和PYY则主要由更下游的小肠和结肠的L细胞产生,只有当食物成分逐渐到达这些远端消化部位时,才会触发它们的释放。完整细胞结构的食物由于更难以消化,促进了这些远端激素的连续而持久释放。 这一发现具有深远的临床和现实意义。
传统营养学多关注食物的宏量营养素组成如碳水化合物、脂肪和蛋白质含量,但忽视了食物物理形态的重要性。而食物结构的微调能够有效地调控肠道激素,间接影响胰岛素敏感性、血糖控制和体重管理,尤其在防治糖尿病与肥胖的领域展现出巨大潜力。 例如,当前市面上广受关注的GLP-1受体激动剂药物(如Ozempic)虽然能有效抑制食欲、促进减重,但属于药物治疗,存在一定副作用风险。通过理解和利用天然食物结构诱导GLP-1和PYY的生理释放,可以实现更安全、可持续的饮食干预策略。 持续释放的GLP-1和PYY除了延长饱腹感,还有助于优化胰岛素敏感性,防止餐后血糖快速升高,进而降低糖尿病的发病风险。与此同时,GIP的快速释放则更适合迅速补充能量,但其过度刺激可能导致脂肪积累,因此从营养角度讲,平衡不同肠道激素的释放尤为关键。
膳食纤维一直被认为是提升饱腹感和调节血糖的重要因子,而这项研究进一步指出,膳食结构对激素释放的机制同样重要。食物的细胞结构及其完整性直接影响淀粉和其他碳水化合物的消化速率,进而影响体内代谢反应。高纤维食物如果保持细胞结构完整,将比被高度加工和破碎的食物更有利于维持长时间的饱腹感和稳定的血糖水平。 这对食品工业的发展提出了新的挑战和机遇。未来的食品设计不仅需要关注营养配比,更需重视食物的物理结构创新。无论是烹饪方式、加工工艺,亦或是食物配方的调整,都可以用以优化肠道激素的分泌曲线,提升饮食的健康效益。
此外,研究中的肠道样本采集技术为精细解析食物代谢过程提供了前所未有的工具。通过了解食物在不同消化部位激活的激素种类和量,营养科学家和医生可以制定个性化的饮食方案,以针对性地调节患者的代谢状态,这对糖尿病、肥胖及其他胃肠疾病的管理意义重大。 这项研究还强调了跨学科合作的价值,结合营养学、生物化学、医学及食品科学,形成系统化理解,推动营养精准医疗的进展。正如帝国理工学院的研究者所言,深刻理解肠道内代谢产物释放及其机制将助力于开发可调控饥饿感的食物,开启“饮食黑客”时代。 总结来说,食物的微观结构对肠道激素的释放模式有决定性影响,进而调控血糖、胰岛素分泌和饱腹感。这一新认识挑战了传统营养只关注成分的理念,强调食物质量和结构的综合作用。
未来,基于结构优化的食品加工和饮食设计将成为提升代谢健康、减少慢性疾病负担的重要方向。消费者、医疗从业者及食品制造商应共同关注这一领域的发展,让科学引领健康饮食新轨迹。