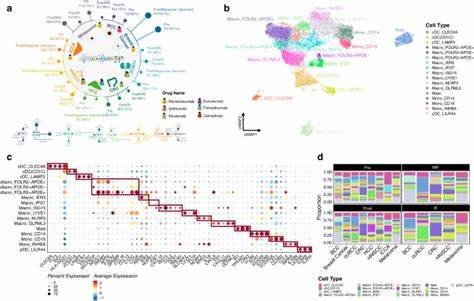
肿瘤微环境(TME)作为癌症发生、发展的关键调控网络,包含各种免疫细胞、基质细胞和相关生物过程。多年来,研究者们不断探索TME中细胞组成与功能的异质性,试图揭示其对肿瘤进程、治疗反应及患者预后的决定性影响。传统的研究方法诸如单细胞转录组和空间组学技术虽具备高分辨力,但受限于技术成本、标记物数量以及样本制备引起的偏差,难以规模化解析大量肿瘤样本的细胞组成。因此,开发基于肿瘤整体转录组数据的计算去卷积算法成为科学界迫切需求。最新研究通过整合多种免疫及基质细胞去卷积工具,建立了涵盖79种肿瘤微环境细胞类型的综合估计体系,为泛癌症背景下深入理解肿瘤免疫生态提供了强有力支撑。研究聚焦于对来自TCGA数据库的10592份不同癌症类型的肿瘤样本进行多工具联合去卷积,产生了独特的细胞类型综合评分(iScore),该评分兼顾各单一方法的优势并最大限度减少单独算法的偏差。
在精确评估免疫细胞(特别是白细胞)与基质细胞的分布及其相互关系的同时,研究通过对比DNA甲基化及肿瘤纯度估计等独立数据集广泛验证了iScore的准确性。分析结果展现出肿瘤微环境在不同癌症类型间存在显著差异,尤其是免疫浸润白细胞的量与组成成为区分癌症亚型的重要指标。值得关注的是,白细胞较高的肿瘤通常预示着更优越的无进展生存率,这为免疫浸润在抗肿瘤免疫中的保护作用提供了证据。然而,脑部肿瘤等少数癌种表现出逆向的免疫细胞相关预后,暗示TME中的免疫细胞在不同组织微环境和肿瘤类型中或具“双刃剑”效应。此外,研究深入解析了多种免疫细胞亚群如细胞毒性T细胞、调节性T细胞、辅助型T细胞亚型对生存的影响及其机制差异,发现CD8+细胞毒性T淋巴细胞及自然杀伤细胞等携带良好预后信号,而调节性T细胞等免疫抑制细胞则在特定癌种中关联不良预后,揭示了免疫细胞组成复杂的生物学意义。基质细胞方面,研究强调了成纤维细胞、内皮细胞及周细胞在促肿瘤和抑肿瘤进程中的双重作用。
基质细胞丰度与肿瘤干性密切相关,提示其参与肿瘤表型塑造和异质性维持。内皮细胞数量的升高在部分癌症中显示良好生存关联,反映血管生成的复杂生物学角色。同时,免疫细胞与基质细胞间的相互作用构成肿瘤组织微环境调控的核心,联合模型显示特定组合的免疫与基质细胞比例能够更有效预测患者预后。为了全面描绘肿瘤微环境的全貌,研究应用高维数据降维及聚类算法,基于79种细胞iScore构建了泛癌症TME地图,揭示41种独特的肿瘤微环境亚群。各亚群间差异主要受肿瘤类型及免疫浸润水平驱动,不同癌症亚型表现出显著异质性。以膀胱癌和皮肤黑色素瘤为例,免疫富集亚群与免疫抑制亚群在患者生存率及基因突变负荷方面显著差异,提示该分型可指导免疫治疗策略选择。
膀胱癌中,免疫富集簇同时具备更高突变负荷及T细胞介导的适应性免疫反应表现,关联较低的疾病进展风险;黑色素瘤中,特定RAS热点突变亚型在免疫活跃簇中同样显示生存获益,表明肿瘤遗传特征与免疫微环境共同影响患者疗效。深入探讨突变基因与肿瘤微环境细胞组成的关系,研究对299个驱动基因进行了广泛关联分析,识别35个与多种免疫和基质细胞类型显著关联的基因。免疫反应相关通路中的CASP8、IRF2等基因突变广泛正相关于多种免疫细胞浸润,暗示肿瘤可能通过这些突变实现免疫逃逸。相反,RAS通路中的NRAS、FGFR3等突变则与免疫细胞浸润负相关,提示其在免疫排斥中的潜在功能。各癌种具有特异的突变-免疫谱关联,如膀胱癌中FGFR3热突变体现出强烈的免疫抑制表型,可能成为免疫治疗联合靶点。此外,肿瘤突变负荷与免疫浸润的相关性并非普遍存在,表明单独的肿瘤突变负荷指标不足以准确预测免疫治疗反应,需结合微环境复杂变量综合评估。
该综合去卷积方法及其关联分析为探索肿瘤免疫机制、预后判断及个体化治疗方案制定奠定了基础。未来,依托这一高分辨的微环境细胞组成图谱,可进一步驱动新型免疫疗法靶点发现,优化免疫治疗患者筛选标准。结合临床多组学数据,将有助于揭示肿瘤免疫逃逸和耐药的生物学路径,促进精准肿瘤免疫治疗的发展。综上所述,泛癌症免疫与基质细胞去卷积技术不仅加深了对肿瘤微环境细胞异质性的理解,更关联了临床预后及基因突变信息,彰显了多工具整合模型在癌症研究与临床转化中的巨大应用潜力,代表肿瘤免疫微环境研究的前沿方向。