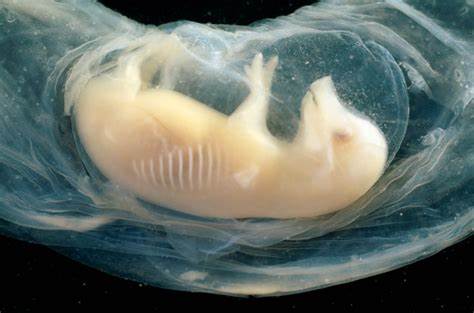
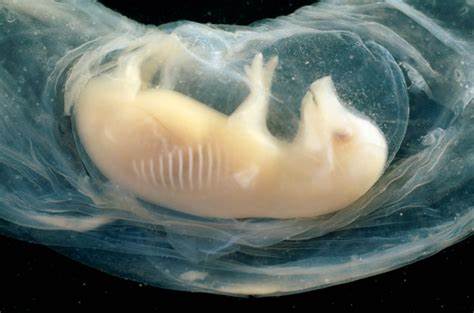
在医学研究领域,培育人体器官一直是科学家们孜孜追求的目标。近日,一项突破性的研究报告揭示,科学家首次在猪胚胎中成功培育出含有人类细胞的微型心脏,这些心脏在胚胎内开始跳动,且胚胎存活时间长达21天。该成果在国际干细胞研究学会上公布,标志着干细胞科学和再生医学的一次重大飞跃。 这一研究利用了猪胚胎与人类干细胞的结合技术,科学家将人类干细胞植入猪胚胎中,促使其在生物环境中发育出初步的人类心脏组织。猪作为实验模型具有解剖结构和生理功能与人体较为接近的优势,借助其胚胎培养,研究人员能够观察到心脏形成的关键过程。这种跨物种胚胎的创建,展示了未来解决供体器官短缺问题的新希望。
具体来说,科学家将具有分化潜力的多能干细胞注入猪胚胎,这些细胞能够发展成各种人体组织和器官。通过精准控制干细胞的类型及数量,研究团队促使这些人类细胞定向生成心脏组织。实验证明,这些生成的心脏组织不仅表现出结构上的心脏特征,更在生理上表现出有规律的跳动。此种功能性表现,是该领域研究的重大突破,说明人工培育器官具备实用的潜力。 过去,由于伦理和技术限制,人类与动物胚胎的混合实验受到严格管控。近年来,随着科学技术和伦理规范的不断完善,相关研究逐渐被允许推进。
此次研究的成功,离不开全球科学共同体对人类-动物胚胎研究的积极响应,以及人工智能、大数据助力下的精准操控技术。研究团队强调,实验严格遵循伦理标准,确保最大限度地尊重与保护生命安全。 该项成果在心脏疾病治疗领域具有深远影响。心脏病一直是全球最主要的致死疾病之一,供体心脏严重短缺成为限制治疗的瓶颈。通过培育个性化人类心脏,不仅有望实现器官移植的突破,减少排异反应,还能够让患者获得更为精准、安全的治疗方案。此外,该技术还可用于疾病模型的建立,供药物筛选和病因研究,为心血管疾病疗法创新提供重要工具。
除此之外,该技术在再生医学中展现了巨大潜力。人体多能干细胞通过定向诱导形成特定器官或组织,意味着未来可以用自体细胞制备缺失或损伤器官,降低免疫排斥风险,实现真正意义上的个性化医疗。 当然,该研究仍处于初期阶段,诸多技术和伦理问题尚需突破。科学家需要进一步提高嵌合体的存活率和成熟度,确保生成的心脏组织功能更加完善。同时,跨物种胚胎研究所引发的伦理争议仍需社会广泛讨论与监管。权威机构和法律法规应建立严格的审查机制,确保研究的安全性、合理性与可持续发展。
未来发展方向可能包括优化干细胞植入技术,提升人类细胞在动物胚胎中的整合效率;研究更多种类的器官形成,拓宽再生医学应用范围;利用人工智能辅助设计干细胞发育路径,提高实验成功率和可控性;进一步解读人类器官发育机制,推动基础生物学研究与临床应用的结合。 这项研究的影响不仅局限于医学和科学领域,也涉及伦理学、法律法规、公共政策等多维度的问题。全球社会需要建立多学科协作平台,加强对科学进展的监督与引导,促进公众对跨物种胚胎研究的理解和接受。只有在科学、伦理、法律全面协调发展的前提下,才能确保研究成果真正造福人类健康。 总的来说,猪胚胎中培育微型人类心脏的成功,预示着器官工程和干细胞治疗的新时代已经来临。这不仅是现代生物技术创新的典范,也是解决器官短缺、改善人类生命质量的重要突破。
未来,随着技术的不断完善与规章制度的完善,类似的生物医学研究将越来越多地走入临床应用,带来无限的希望和可能。