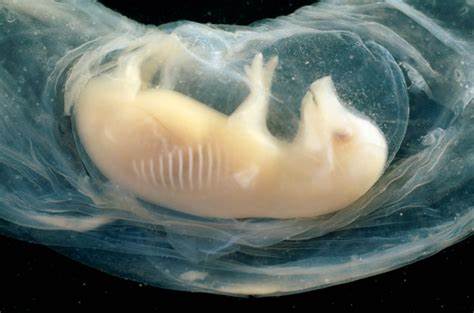
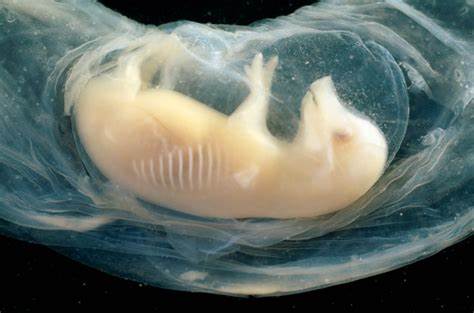
在现代生物医学的探索道路上,一项引人注目的科学突破引发了全世界的关注。科研团队首次成功在猪的胚胎中培育出含有人类细胞的微型心脏,这些心脏在胚胎存活的21天里开始跳动,展示出惊人的生命活力和潜力。这一研究不仅揭示了人类和动物间细胞融合的新可能,也为未来的器官移植和再生医学开辟了令人期待的希望之门。猪作为实验模型因其生理结构与人类相似,近年来在医学研究中扮演着越来越重要的角色。而通过将人类干细胞注入猪胚胎,科学家能够在动物体内观察人类器官的发育过程,这样的人工“嵌合体”技术为解决器官短缺问题提供了全新思路。此次实验使得研究者们可以更加深入地了解心脏在发育初期的复杂机制,尤其是心脏的形成、节律启动以及心肌细胞的组织构建。
微型人类心脏的成功跳动表明,这些移植的细胞不仅存活下来,并且开始承担心脏的基础生理功能。研究人员在国际干细胞研究协会的一次会议上公布了这一成果,会议上受到了众多科学家的热烈关注和积极评价。实验中,团队选用了高效的人类多能干细胞,将其植入猪胚胎的心脏发育区域。经过21天的孕育,这些小型心脏组织不仅生长完善,还表现出类似于人类心脏早期跳动的节奏。这样的发现对于心血管疾病的治疗研究具有重要意义。在未来,利用类似的技术生长出可用作移植的人类完整器官将成为可能,这不仅能缓解全球范围内捐献器官短缺的瓶颈,还能极大减少免疫排斥反应的问题。
事实上,免疫排斥是目前异种移植最大的挑战之一,而通过基因编辑和精准干细胞技术生成的“个性化”器官,可能帮助受体更容易接受移植的器官,提高移植成功率和受体的生活质量。当然,这项技术仍处于初期阶段,科学社区需要更多的研究来确定安全性、伦理规范以及技术的可行性。人类与动物细胞融合的研究一直以来都面临伦理和法律的双重挑战,公众对于人类胚胎和动物胚胎融合实验怀有种种疑虑。因此,科学家们在这一领域积极寻求透明的沟通平台,推动科学与社会的良性互动。与此同时,这项研究也激发了干细胞研究、基因编辑以及组织工程领域的深度融合。通过精确控制干细胞的分化和生长环境,科学家们能够指导细胞按照预设程序形成特定的组织或器官。
利用猪胚胎作为生长“工厂”,不仅资源丰富且成本相对较低,也为实验大规模实施提供有力保障。此外,这次研究启示我们可以利用跨物种间的生物兼容性,突破传统医学中对人类器官来源的依赖。对于心脏病患者而言,此项技术在不远的将来有可能带来革命性的治疗手段,尤其是在心脏移植等待名单长达数年的严峻现实面前,这种创新模式显得尤为重要。针对此类实验产生的伦理争议,国际社会正在陆续出台相关指导原则,强调严格限度的实验时间、细胞类型的选择以及对实验动物福利的保护。只有在确保伦理和科学安全双重要求的基础上,这一领域的研究才能持续推进。未来,随着技术的不断完善和跨学科合作的深入,人类器官培育技术必将迈向更成熟、更实用的阶段。
科学家期望通过不断试验,不仅实现心脏器官的成功发育,还将逐步实现肝脏、肾脏等其它重要器官的生长培养,从而彻底革新人类医疗体系。总的来说,猪胚胎中培育微型人类心脏的成功,是现代生物技术和医学研究的里程碑。它代表了人工器官培育技术的一大飞跃,昭示了未来器官移植将迎来前所未有的变革。此项研究融合了先进的干细胞科学、基因编辑技术和动物模型应用,展现出跨学科合作的强大力量。随着更多科学突破不断涌现,医学界将更加接近实现“按需生成”器官的梦想。对于广大患者而言,这无疑是一道曙光,是迈向治愈与新生的新起点。
。