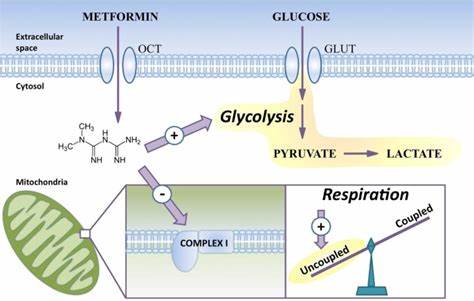
近年来,二甲双胍作为一种广泛应用于治疗2型糖尿病的药物,其在神经保护和神经再生领域的潜力逐渐受到关注。尤其是在促进中枢神经系统中少突胶质细胞功能方面,二甲双胍展现出了独特且积极的作用。少突胶质细胞是形成髓鞘的关键细胞,髓鞘对神经信号的快速传递和神经轴突的代谢支持不可或缺。在多发性硬化症等疾病中,髓鞘的脱失直接导致神经功能障碍。当前的研究结果表明,二甲双胍能够通过影响线粒体相关的代谢途径,促进少突胶质细胞的分化和髓鞘的再生,为相关疾病的治疗开辟了新的方向。二甲双胍最初被确认为可降低血糖的药物,随着对其作用机制的深入研究,发现其不仅仅涉及糖代谢的调控,更关键的是通过抑制线粒体呼吸链复合物I,诱导细胞内能量状态的变化,激活能量感应器AMP激酶(AMPK)信号通路。
这一过程促进了代谢的重塑,提高了细胞的代谢灵活性和应激响应能力。在老龄化或者受损状态下,少突胶质前体细胞(OPCs)对分化信号的反应能力下降,导致髓鞘修复效率降低。二甲双胍可以在一定程度上"使老化的OPCs恢复年轻状态",增强它们对促髓鞘形成信号的敏感性和响应能力,从而促进再髓鞘形成。科学家通过对人类胚胎干细胞来源的少突胶质细胞进行研究,发现二甲双胍能够显著提升其向成熟少突胶质细胞分化的比例,无论是在单层细胞培养体系还是在三维类脑器官系统中,都展现出了促进髓鞘蛋白表达的能力。移植到免疫缺陷小鼠脑内的研究模型中,二甲双胍处理组显示出更多的人源少突胶质细胞髓鞘包裹轴突,显示出生理功能上的提升。更重要的是,电子显微镜分析揭示,二甲双胍不仅增加了髓鞘覆盖的轴突比例,还引起了线粒体形态学的明显变化,线粒体面积显著增大。
这种变化在轴突和少突胶质细胞的胞质内均有发现,提示二甲双胍可能通过提升线粒体的功能状态,增强细胞的能量供应能力,从而支持髓鞘的合成和维护。线粒体作为细胞的能量工厂,其功能的优化对于髓鞘形成至关重要。髓鞘的生物合成需要大量的ATP支持,而线粒体通过呼吸链产生的能量正是满足这一需求的关键。二甲双胍通过调整线粒体电子传递链相关基因的表达,如NDUFA11和COX8A等,进一步优化线粒体的代谢效率。此外,二甲双胍提升了翻译起始因子EIF1的表达,这与线粒体mRNA的选择性翻译和蛋白质合成密切相关,展示了其在细胞蛋白质合成调控中的作用。这些分子水平的变化不仅限于人类少突胶质细胞,在小鼠的脑内不同类型细胞如神经元、星形胶质细胞和小胶质细胞中也观察到了类似的上调,说明二甲双胍的代谢调控具备广泛的细胞适用性。
临床上,少数接受二甲双胍治疗的多发性硬化症患者脑组织的单核RNA测序数据显示,EIF1的表达也有上升趋势,暗示其在人体内同样发挥代谢调节和潜在的神经保护作用。当然,目前临床数据仍有限,二甲双胍在神经系统疾病中的具体疗效和机制还需更多高质量的临床试验验证。然而,综合基础研究的发现,二甲双胍的多重代谢调控特性,使其成为了治疗神经退行性疾病,尤其是那些涉及髓鞘损伤和修复障碍疾病的有力候选药物。对于未来的神经科学研究,值得进一步探讨二甲双胍在促进中枢神经系统再生、延缓神经退行以及改善神经代谢障碍中的潜力。随着类器官、动物模型和单细胞测序等先进技术的结合,二甲双胍作用机制的细节将逐步揭示,帮助我们优化治疗方案,提升患者生活质量。同时,二甲双胍的安全性和成本效益优势,为其快速转化为神经疾病的治疗手段提供了可能。
在慢性病管理和神经疾病治疗日益融合的背景下,二甲双胍不仅仅是控制血糖的药物,更有望成为神经保护和修复领域的多功能药物。展望未来,基于代谢调节的神经再生策略将引领医药科技新潮流,二甲双胍在其中或将扮演重要角色。 。