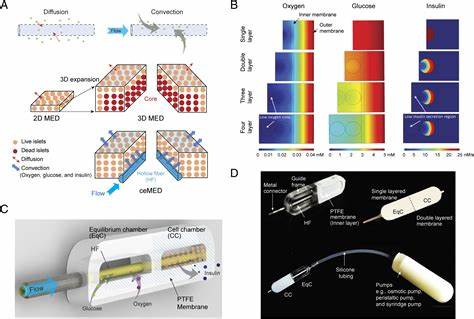
糖尿病特别是1型糖尿病的治疗一直是生物医药领域的重大挑战。传统的外源性胰岛素注射虽能缓解病情,但无法根治疾病且需患者持续精确掌控,增加了严重低血糖事件及长期并发症的风险。细胞疗法因其能够模拟内源性胰岛β细胞功能,自主调节血糖水平,而成为实现糖尿病治愈的理想途径。然而,如何有效移植胰岛素分泌细胞,避免免疫排斥且保持细胞长期存活和功能,是现有技术面临的难题。 为解决免疫抑制副作用及移植安全性问题,细胞包埋技术应运而生。该技术通过将胰岛素分泌细胞封装在具选择性渗透性的半透膜中,既阻隔免疫细胞的直接接触,又允许养分和胰岛素自由交换。
然而,包埋系统普遍存在氧供应不足的问题,特别是在置于皮下等非直接血管化位点时。胰岛β细胞对氧气需求极高,缺氧将导致细胞凋亡及功能丧失,直接限制了包埋细胞的密度和疗效。 最新研究推出了一种创新的大规模氧合宏包埋系统(BioElectronics-Assisted Macroencapsulation System,简称BEAM),有效解决了氧气供应瓶颈。该系统结合了迷你型植入式电化学氧气发生器(implantable Electrochemical Oxygen Generator,iEOG)与可伸缩的线性细胞囊袋,能够基于组织间隙水分持续产生氧气,确保封装细胞环境持续拥有足够氧气,支持高密度细胞加载(高达60000 IEQ/mL)。 该电化学氧气发生器利用电解组织中的水汽,产生纯净氧气和氢气,两者分别通过分离的出口释放,避免混合产生安全隐患。设备尺寸小巧,外壳采用医用级钛合金,具备良好生物兼容性和耐久性,同时设有多层电极组件,实现稳定且可控的氧气产生速率。
电流强度调节范围广,可灵活调整氧气释放量,以满足不同细胞类型和移植剂量的需求。 线性核心-包膜结构的细胞囊袋设计尤为关键。包膜采取医用级聚醚嵌段酰胺(PEBAX)通过静电纺丝工艺制备,形成柔软且高度多孔的纤维膜,膜层间渗透有高度纯化的海藻酸盐水凝胶,以实现免疫隔离并保证养分及代谢废物自由交换。囊袋采用无棱角圆端筒状结构,避免传统密封工艺中产生的尖锐边缘引起的组织刺激和纤维化,加强机械柔韧性并方便微创植入及取出。对于加长囊袋,还可以通过镍钛合金网架增强形状记忆和耐用性,防止术后变形。 细胞加载借助定制的不粘性四氟乙烯管道工具,确保细胞在包膜与氧气管之间均匀分布,形成薄层状细胞凝聚体。
包膜通过离子交联的方法快速固化,固定细胞同时缩短氧气扩散距离,极大提升质料传输效率,缓解氧气梯度限制。氧气通过一条硅胶内管释放,保证封闭空间内氧气均匀供应,维持细胞活力和功能。 体外实验中,使用与胰岛大小及耗氧率类似的INS-1细胞团以及高纯度人胰岛细胞为模型,模拟皮下极低氧环境(1%氧气即约7.6毫米汞柱)。对比实验结果显示,BEAM系统可显著降低细胞凋亡率,维持细胞形态和功能蛋白表达,如胰岛素和胰高血糖素。为期24至72小时的实验中,氧气发生器组表现出明显优于无氧组的胰岛素释放活性,证明持续供氧对封装胰岛细胞功能的重要性。 进一步的动物实验采用糖尿病大鼠模型进行异体胰岛细胞移植,加装BEAM系统的组别在无免疫抑制条件下,术后三天即恢复正常血糖水平,并维持近三个月稳定血糖,而未供氧的对照组依旧高血糖。
体内持续氧供不仅支持高细胞密度,还显著提高移植物生存率,降低纤维化程度。移除装置后的组织学分析表明氧合组胰岛细胞保持形态完整,胰岛素表达强烈,功能检测亦证实其对葡萄糖刺激的敏感性。值得注意的是,氧气供应中断后,动物血糖迅速反弹,强调氧气供应的连续性对于细胞功能持久性的必要性。 综合以上,BEAM系统为胰岛素分泌细胞的宏包埋提供了创新解决方案。其持续、可调节的氧气供应打破了过往包埋技术在血氧供应不足导致细胞功能衰竭的局限,实现了临床有效剂量细胞的高密度封装。线性、柔性的设计便于微创植入和完整取回,充分考虑了患者安全和治疗便利性。
未来,通过无线充电方式实现电池的长期维持,将极大提升该技术的临床应用潜力。 尽管如此,仍需克服一些挑战以推动临床转化。其中包括设备尺寸的进一步微型化、氢气副产品的安全散逸策略,及防止过量氧气累积引起的局部组织分离。开发智能传感器进行闭环氧气调控,将提升系统智能化和安全性。规模扩大后,也需评估人体免疫反应和组织兼容性,确保长期稳定表现。 总之,氧合宏包埋系统以其独特的电化学供氧技术和优异的材料设计,极大提升了胰岛素分泌细胞移植治疗糖尿病的可行性和效果。
该技术或将引领细胞替代疗法向无免疫抑制、可持续的疾病根治方向迈进,成为治疗1型糖尿病及其他需细胞疗法疾病的未来突破口。随着相关技术的进一步完善和临床试验的推进,人类对胰岛素依赖的终结或许近在咫尺。 。