艾滋病病毒1型(HIV-1)作为一种能够长期潜伏于人体免疫系统内的病毒,其潜伏状态的维持和逆转一直是治疗中的重大难题。潜伏病毒的存在使得患者病毒无法彻底根除,带来了复发和病情控制困难的挑战。近年来,科学研究聚焦于病毒编码的反义转录本(AST),通过异位表达这一分子来实现对HIV-1潜伏的控制和逆转,展现出极具潜力的治疗前景。HIV-1的潜伏主要依赖病毒基因组整合在宿主细胞染色质内,特别是在其5′长末端重复序列(LTR)的调控区域。LTR区域的染色质状态决定了病毒基因表达的开关,即活跃转录或潜伏状态。调节染色质结构的关键因素包括核小体定位及其上的组蛋白修饰,例如组蛋白H3第27位赖氨酸的三甲基化(H3K27me3),这一表观遗传标记会促进染色质紧缩,抑制转录。
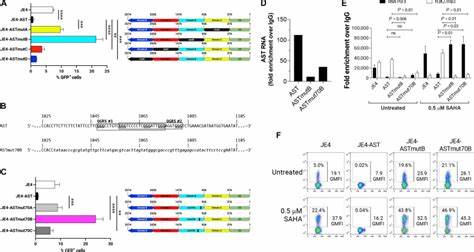
多聚梳抑制复合物2(PRC2)是催化这一组蛋白修饰的酶复合物,其缺乏DNA直接结合能力,往往依赖长非编码RNA(lncRNA)及天然反义转录本(NATs)引导至特定基因区域。HIV-1病毒表达的反义转录本AST恰恰起到这一关键桥梁的作用。AST长达2574个核苷酸,自3′LTR的负链启动子无须Tat蛋白即可转录,覆盖了U3区到nef基因的一部分区域。通过基因组定位研究显示,AST能够招募PRC2至HIV-1的5′LTR,促进核小体的组蛋白甲基化,构建闭合的染色质环境,从而有效抑制病毒转录,维持潜伏状态。研究者进一步通过生成AST的系列结构域和序列突变体,揭示了AST不同结构域在潜伏调控中的功能分工。U3区位于AST的5′端,与病毒的5′LTR存在完整序列同源性,其中两个多嘧啶(Y-rich)序列对于AST与5′LTR的直接结合至关重要。
突变这两个多嘧啶区域会导致AST丧失与5′LTR结合能力,从而减弱其潜伏促进功能。与此同时,AST的B区富含能够形成G四联体结构的G-rich序列,正是PRC2招募的结合位点。干扰该区域同样降低了AST结合PRC2复合体的能力,减弱了组蛋白H3K27三甲基化的沉积,促进病毒从潜伏状态激活。除U3和B区外,AST的C、D两个区域虽然单独影响有限,但共同参与和其他宿主的转录抑制因子形成多分子复合物,维持病毒染色质的沉默状态。实验通过尺寸排阻色谱确认AST参与了超过2兆道尔顿的大型多蛋白集群的形成。此外,利用标记的AST RNA亲和纯化结合质谱技术(LC-MS/MS),筛选出多种与AST结合的宿主因子,其中包括参与染色质重塑的SWI/SNF复合体亚单位、核糖核蛋白家族成员以及涉及RNA结合和异源染色质形成的蛋白。
这些蛋白不仅提供了对染色质结构调控的支持,也揭示AST通过招募多种功能因子以协同方式实现病毒基因表达抑制的机制。在临床相关性方面,研究团队通过体外将AST基因导入抑制性抗逆转录病毒治疗(ART)下的感染者CD4+ T细胞中,发现AST异位表达显著阻止了外源刺激诱导的病毒潜伏逆转,无论是药物刺激还是T细胞受体激活均不可逆转地抑制病毒转录水平。这表明高浓度的AST能够强化病毒整合位点的闭合染色质状态,设定较高的激活阈值,防止潜伏病毒被半激活环境诱导表达,极大增强潜伏的稳定性。除了基因调控机制,AST结构的复杂性和二级、三级构象使其成为多种RNA结合蛋白的作用平台,此外,发现AST harbors多种RNA修饰如2′-O-核糖甲基化、假尿苷化和腺苷脱氨基编辑,这些表观修饰可能增强其与蛋白质的结合亲和力及特异性,促进功能性复合物的组装和稳定。综合研究成果表明,针对AST的生物学功能展开疗法设计具有重要现实意义。传统“激活并清除”(shock and kill)策略的局限性在于潜伏病毒难以被有效激活,且激活过程中可能引发免疫逃逸和病毒反弹。
相比之下,基于AST的“阻断并锁定”(block and lock)策略更偏重于稳妥加强潜伏状态,防止病毒转录激活,具有显著的治疗耐受性和持久控制潜力。通过载体介导的AST异位高表达,增浓病毒潜伏调节复合物,为抑制病毒复制提供了新颖且精准的分子靶点。同时,鉴于AST序列跨越病毒多个关键区域,其相对保守性为避免病毒逃逸突变提供了保障。在未来临床应用中,如何高效且安全地递送和表达AST,优化其表达稳定性,减少潜在副作用,将是重点攻关方向。结合精准基因编辑、RNA生物技术以及纳米载体等多核技术的融合应用,将促进AST相关疗法从实验室走向临床。HIV-1潜伏逆转的研究正进入以RNA调控为核心的新阶段,病毒反义转录本作为潜伏调控分子网络中的关键节点,提供了丰富的靶向干预策略和全新治疗理念。
期待未来更多跨学科合作和创新技术推动AST相关研究,实现艾滋病毒感染的功能性治愈和长远免疫重建。