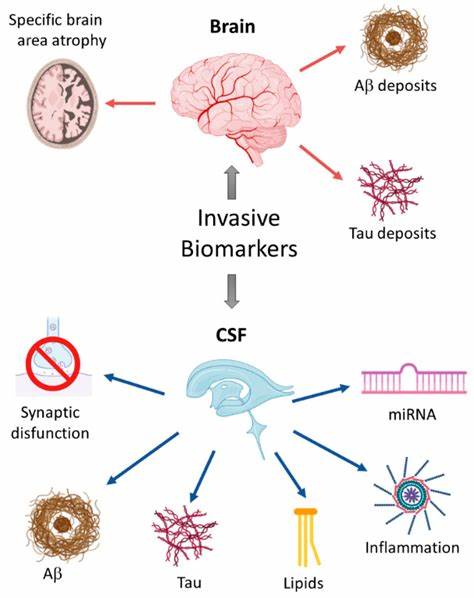
近年来,阿尔茨海默病作为最常见的神经退行性疾病,备受医学界关注。其病理特征主要包括β-淀粉样蛋白斑块的堆积及tau蛋白异常磷酸化形成神经纤维缠结,这些病理变化直接导致神经细胞损伤及认知功能下降。普遍观点认为,tau蛋白的异常磷酸化是疾病恶化的标志,尤其是血浆中p-tau217蛋白水平升高被视为阿尔茨海默病诊断与病程监测的敏感指标。然而,来自瑞典哥德堡大学和国际合作团队最新研究却揭示了一个引人深思的现象——新生儿体内的p-tau217水平远高于成人,甚至高于阿尔茨海默病患者。这种异常升高的表达,并非疾病风险的征兆,而是一种健康且必要的生物学现象。此发现首次在人类新生儿血液中测得p-tau217的浓度,为该生物标志物的复杂生物学角色增添了新的维度。
过去,科学家们仅在动物模型中推测tau蛋白的磷酸化可能参与脑的早期发育,而该人类研究则为这些假设提供了实证基础。研究涵盖了包括健康新生儿、早产儿、青年和老年成人以及阿尔茨海默病患者在内的400余名受试者,结果显示新生儿血浆p-tau217水平显著最高,尤以早产儿为甚。此外,这一高水平会在生命的最初几个月逐渐下降,最终接近成年人正常值。研究引发的最大疑问是,为什么同一个蛋白质即在新生儿脑内促进神经元生长与连接形成,在阿尔茨海默病患者的大脑却成为破坏细胞的罪魁祸首。专家分析认为,这种磷酸化tau蛋白在新生儿中支持神经网络的塑造、神经轴突的延伸以及突触发育,这对于迅速适应外界环境和完成神经调控功能至关重要。相比之下,成年大脑中由于代谢环境、细胞老化及其他神经病理过程的影响,p-tau217逐渐失去正常调控,形成有毒的缠结结构,最终导致认知退化。
该研究还指出,新生儿体内p-tau217水平与出生早产时长存在紧密相关性,出生越早,蛋白质含量越高,反映其在逆境中对快速脑发育的支持作用。科学家提出假设,新生儿阶段大脑可能拥有一种特有的保护机制,能有效防止p-tau217的毒性体现,使其在促进脑功能形成的同时不至于伤害神经细胞。而随着年龄增长,这种保护机制逐步减弱或丧失,从而激发tau蛋白的病理性积聚。理解这一自然保护机制,或许是未来开发阿尔茨海默病创新疗法的重要突破口。研究团队负责人强调,模拟或激活新生儿脑中保持tau正常功能的机制,可能帮助延缓或阻止疾病的进展,为患者带来新的治疗希望。除了为神经科学提供理论基础外,p-tau217作为血液标记物的FDA认证,也推动了其在临床早期诊断中的广泛应用。
然而,研究亦提醒,解读检测结果需充分考虑被测个体年龄及可能的生理变化,避免误判。科学界对于p-tau217升高的成因传统理解以为其必然伴随β-淀粉样蛋白的聚集形成淀粉样斑块,但本次研究发现新生儿体内尚无此类病理变化,说明其表达机制另有不同。整体而言,这项跨国联合研究不仅加深了人们对tau蛋白双重功能的认识,同时也呼吁科学家重新审视阿尔茨海默病的发病机制及早期诊断指标的科学解释。脑的发育与疾病的关系日益成为神经科学前沿领域,借助新生儿高p-tau217水平的发现,未来或能揭开更多大脑神秘规律。在临床上,这意味着将来针对tau蛋白相关疾病的治疗策略可能更趋精准和个性化,基于年龄和发育阶段采取差异化干预。科研界期待该发现能促进跨领域合作,结合分子生物学、发育神经学及临床医学,共同攻克老龄化社会中日益严重的神经退行性疾病难题。
同时,也为生命科学关注儿童神经健康和早期干预提供方向。总而言之,新生儿体内p-tau217生物标志物水平的意外升高,是一则探索健康大脑成长及阿尔茨海默病发病机制的科学佳讯。它提醒我们,同样的分子在不同生命阶段可能扮演截然不同的角色。深入理解tau蛋白在人体神经网络中的复杂调控,将为药物研发和疾病预防带来革命性的影响。未来,科学家们将继续追踪p-tau217的动态变化及其调控因素,力求解锁大脑自我保护的奥秘,从而转化为实用的医疗方案于广大患者,为人类健康长寿注入新的活力和希望。