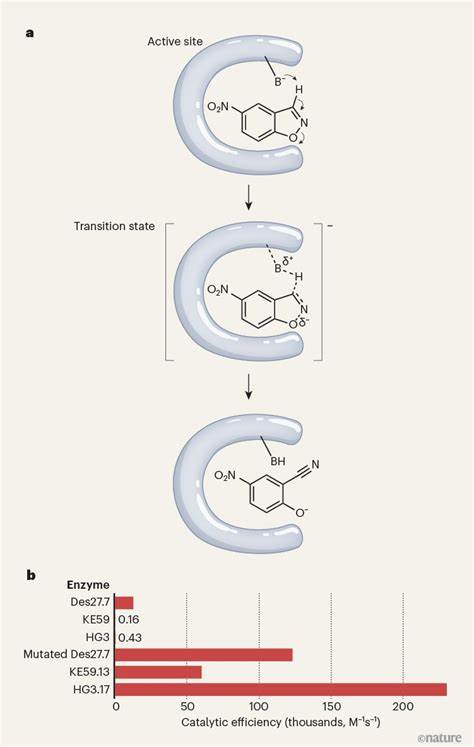
酶作为生命体内催化化学反应的关键蛋白质,承担着多种生物过程中的重要职责。经过数十亿年的自然进化,天然酶展现出极高的催化效率和底物特异性,甚至部分酶被誉为“完美酶”,例如三磷酸异构酶(TIM),其能够在中性pH条件下,将相关反应速率提升超过十亿倍。生物科学家和工程师们长期以来一直试图通过人工方法设计高效酶,以迅速推进酶性能的优化,从而服务于医药合成、环境保护、工业催化等领域。然而,传统的酶设计往往面临效率不及天然酶的瓶颈。近期,Nature期刊报道了一项突破性的研究成果:研究者通过全新的计算工作流程,成功设计出催化效率接近甚至媲美天然酶的人工酶,这标志着蛋白质设计领域迈入了新纪元。 人工设计酶的核心挑战在于对蛋白质三维结构和动态行为的精准预测。
酶的催化作用不仅依赖于其活性位点的化学性质,更与蛋白质整体的折叠方式、构象变化密切相关。早期的计算设计方法通常基于静态结构模型,忽略了酶的灵活性和环境因素,导致设计酶的催化活性远远落后于天然酶。随着计算能力的提升和物理化学知识的积累,科学家开始将分子动力学模拟、量子力学计算等多尺度方法结合应用,使设计流程更加贴近实际反应机理。 此次突破性研究所采用的计算平台,融合了机器学习与基于物理的建模技术,能够在海量蛋白质构象中筛选出最优的催化空间布局。研究团队根据目标反应的具体需求,先设计出最适符合催化机制的活性位点,再通过迭代优化调整氨基酸的侧链排列和主链结构,确保催化环境的精准实现。同时,设计流程中还加入了对酶活性稳定性的预测,使得最终合成的酶不仅高效而且具备较强的热稳定性和耐久性。
值得一提的是,所设计的人工酶在多种标准测试反应中展现出优异的性能。其催化效率在某些案例中达到了天然酶的70%至90%,这一数据远超以往任何人工酶设计成果。此外,这些酶在常温常压、环保溶剂条件下依然保持高活性,极具实际工业应用潜力。通过与传统酶工程技术的结合,未来有望进一步提升人工酶的适应性并缩短新酶的研发周期。 人工高效酶设计技术的发展,不仅推动了基础生命科学研究的进步,也带来了广泛的产业变革。制药行业中,许多关键药物合成反应依赖于高效选择性催化剂,人工设计酶能够精确匹配目标反应,极大地提升合成效率,降低副产物生成,实现绿色制造。
环境治理领域,通过设计能够降解难降解污染物的专用酶,可创新性地解决持久性有机污染难题。农业科学亦可借助高效酶优化土壤养分循环和植物病害防治,提高作物产量及质量。 展望未来,随着人工智能和计算硬件的持续进步,蛋白质设计的自动化和智能化水平将进一步提升。深度学习模型能够从海量蛋白质数据库和实验数据中学习复杂的结构与功能关系,生成更加精准和创新的酶设计方案。同时,高通量实验筛选技术的结合,能够快速验证和迭代优化计算设计成果,缩短从设计到应用的时间跨度。未来的研究可能聚焦于多功能酶设计,兼具高催化效率与多种环境适应性,满足更加复杂的生物及工业需求。
总之,从零开始设计高效酶的技术突破,不仅验证了计算蛋白质设计的巨大潜力,也为未来生物技术的创新开辟了新途径。这一里程碑式成果昭示出人类正逐步掌握借助计算力量塑造生命分子的能力,推动科学与产业共同迈向可持续、绿色和智能的新时代。对科研人员、企业家乃至广大公众而言,这不仅是酶工程领域的胜利,更是生命科学与技术融合发展的光明前景。