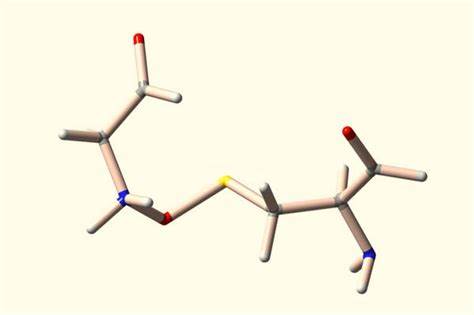
蛋白质是生命活动的基础,其三维结构的形成依赖于多种分子间的相互作用。多年来,科学家们通过X射线晶体学等技术揭示了许多构成蛋白质的非共价和共价键,丰富了人类对蛋白质构象和功能的认知。然而,最新的研究成果显示,在大量已解析的蛋白结构数据库中,一种被忽视的共价键模式——氮氧硫(NOS)键,广泛存在于众多蛋白质中,令人震惊地打破了传统认知。 传统观点认为,蛋白质结构中以非共价键为主导,如氢键、静电作用力和范德华力,负责蛋白质折叠与稳定,而共价键如半胱氨酸之间的二硫键,则作为蛋白质结构中的关键调控开关存在。这些二硫键被认为能够在氧化还原状态变化时断裂和重组,从而实现蛋白功能的调控。近年来,科学家发现了一种新型的红氧化还原开关——NOS键,这种桥联结构连接了蛋白质中的氨基酸残基,尤其是半胱氨酸和赖氨酸、精氨酸、甘氨酸等之间的相互作用。
这一发现依托于德国哥廷根大学的Sophia Bazzi博士和Sharareh Sayyad博士带领的研究团队,他们采用了机器学习和量子力学计算方法,系统分析了超过86000个蛋白质的X射线晶体结构数据,以捕捉结构中可能遗漏的氮氧硫键。通过这一创新工具,团队揭示了69处此前未被报道的NOS键,涵盖了多种蛋白家族。这不仅说明了现有蛋白质数据库和AI预测工具在解析特殊化学键方面的局限,也预示着蛋白质内部化学世界的丰富多样性尚未被完全发掘。 此前,哥廷根大学的另一个科研团队在2021年首次报道了NOS是否定类型的共价桥链接,它连接了半胱氨酸和赖氨酸,并且表现出类似“发条机制”的特性,能够根据蛋白质的氧化还原状态改变其构象。此发现最初是在针对淋病奈瑟菌的蛋白质中识别的,暗示NOS键具备调节蛋白功能的潜力。随着研究的深入,NOS键的范围被扩展到与精氨酸和甘氨酸的连接,为理解蛋白质功能多样性提供了新的化学视角。
在蛋白质结构解析中,晶体学家们将电子密度图转换成三维蛋白模型时,依赖于现有的化学知识库和假设,可能导致一些特殊甚至异常的原子排列被归入“过于接近的接触”而未被识别为真正的化学键。正如Bazzi博士指出的,倘若底层数据遗漏了某些键的确切存在,那么以这些数据为训练基础的AI模型也无法准确预测这些结构。此类盲区的发现促使科学界反思现有蛋白质结构解析和AI应用的限制。 NOS键的发现不仅丰富了蛋白质化学的知识体系,还带来了潜在的功能和应用启示。蛋白质的空间构象是决定其功能的关键,而NOS键作为一种新型的可逆或不可逆共价调控机制,或许能成为蛋白质红氧化还原调控的又一类重要开关。事实上,2024年初一个跨国合作团队报道了在新冠病毒SARS-CoV-2的半胱氨酸蛋白酶中发现了类似的红氧化还原开关,该机制有助于该酶在氧化环境中保持结构稳定,从而抵御人体免疫系统的攻击。
这一发现已为针对病毒蛋白的抗病毒药物设计指明了方向:搭载这样开关的蛋白成为理想的药物干预靶点。 当然,对于NOS键是否是动态可逆的调控元件,学界仍存在争议。澳大利亚悉尼Centenary研究所的蛋白质化学家Philip Hogg对这项研究给予认可,承认NOS键作为结构性连接真实存在,但他也指出,目前尚无确凿证据支持其像二硫键那样能断裂与重组,即是否具备动态开关功能。科学家们期待未来若能发现专门的酶或其他因素介导NOS键的动态变化,将极大提升其作为药物靶点的价值与潜力。 这一系列研究成果标志着蛋白质化学研究正进入一个全新阶段,不再局限于传统已知键的探寻,而是不断开拓底层的生物分子化学互动世界。Bazzi博士团队正计划扩展这类方法,继续检索公开蛋白质结构,寻找更多被忽视的共价修饰和化学结合模式。
现代蛋白质工程和药物开发离不开对蛋白质结构与功能的深刻理解。氮氧硫键的揭示为精细调控蛋白质活性和稳定性提供了新的思路,尤其在复杂疾病治疗和疫苗设计领域具有广阔的应用前景。随着技术的持续进步和更为精准的分析手段,未来我们有望看到更多类似的隐藏化学键被发现,推动生命科学研究走向更深层次的分子精细调控和创新。 综上所述,氮氧硫键作为蛋白质内部一种此前被忽视的重要共价连接,正在逐步显现其在生物分子稳定性和功能调控中的潜力,挑战了我们对蛋白质结构复杂性和多样性的传统理解。未来加深对这种新型化学键的研究,将为生物医学科学开启新篇章,有望加速新药研发与生物工程的突破。随着科学界对蛋白质微观结构和化学互动的进一步探索,人类对生命的分子秘密也会愈发洞彻,推动健康科学迈向更辉煌的未来。
。