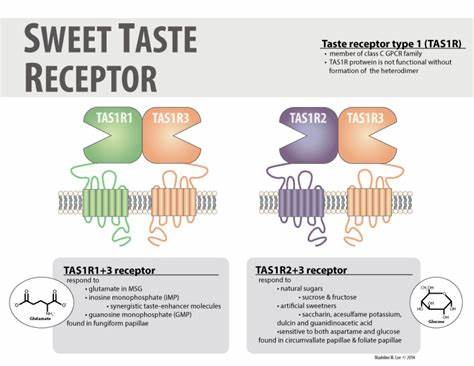
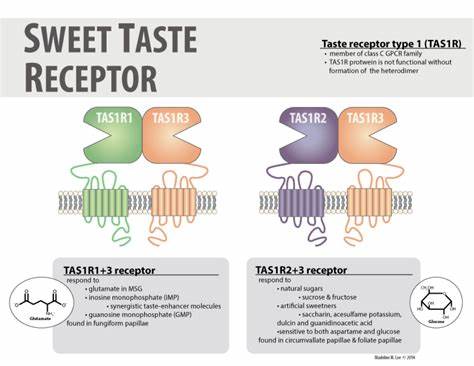
甜味作为人类基本味觉之一,不仅深刻影响着我们的饮食选择,还与代谢健康密切相关。随着人们对甜味受体结构与功能认识的不断深入,科学家们正逐步揭开这一复杂受体家族的神秘面纱。人体甜味受体主要由两种亚单位组成,TAS1R2和TAS1R3,它们形成一个异源二聚体,属于Class C类型的G蛋白偶联受体(GPCR)。该受体能够识别天然糖类、人工甜味剂以及甜味蛋白等多种甜味物质,其信号传导不仅限于味觉感知,还涉及体内多种代谢调控机制。长期以来,缺乏完整的三维结构一直阻碍我们对其分子工作机制的全面理解,直到最近,基于先进的冷冻电子显微镜(cryo-EM)技术,研究团队成功解析了人类甜味受体在无配体(apo)和结合甜味剂蔗糖素状态下的全长三维结构。研究显示,TAS1R2和TAS1R3之间呈现显著的不对称结构,这一发现颠覆了过去对受体对称性的认识。
值得注意的是,蔗糖素仅结合于TAS1R2的招蜂花捕蝇草结构域(Venus Flytrap Domain, VFTD),这一结合位点的发现为深入探讨甜味物质识别方式提供了关键线索。通过系统性的突变分析和分子动力学模拟,科学家们揭示了TAS1R2中甜味剂的多种结合模式,具体氨基酸残基的作用机理得到了明确刻画。这些结构上的差异和配体诱导的构象变化共同参与了受体的激活过程。相比之下,TAS1R3在甜味识别中的作用更多是辅助性和信号转导相关,其结构上的稳定性为整体受体的功能完整性提供保障。相较于同属Class C GPCR的其他受体,如谷氨酸受体和GABAB受体,甜味受体展现出独特的激活机制和结构复杂性。构象变化主要集中在VFTD的闭合运动及其与连接结构域(Cysteine-Rich Domain, CRD)的交互,进而影响跨膜结构域(Transmembrane Domain, TMD)的构象调整,引发细胞内信号传递级联反应。
这一系列分子事件为甜味受体从感知外部甜味信号到激发细胞内反应的过程提供了分子基础。蔗糖素作为一种常用的人工甜味剂,其与受体的结合不仅被观察到明确的结合模式,还揭示了结合后诱导的构象变化对受体活化的重要影响。分子动力学模拟显示,蔗糖素在结合位点上的稳定性和特异性相对较高,这有助于解释其甜度强度及持续性。进一步的功能验证实验支持这些结构生物学发现,多个关键残基的突变显著影响了受体对不同甜味物质的响应,印证了结构与功能间的紧密联系。甜味受体的特殊性质和多样的配体识别能力使其成为甜味剂设计的理想靶点。深入理解其结构激活机制不仅有助于开发更安全、味道更自然的非糖甜味剂,还有望帮助控制饮食相关的代谢疾病,如肥胖和糖尿病。
最新的研究成果还指出,甜味受体在体内的表达位置远超味觉系统,包括肠道、胰腺甚至某些脑区,暗示其在能量代谢和内分泌调节中的潜在作用。基于AlphaFold等人工智能工具的结构预测为受体与G蛋白复合体的结合模式提供了新的视角,未来结合高分辨率结构和动态模拟技术,将进一步揭示甜味受体完整的信号转导网络。此外,冷冻电子显微镜技术及其伴随的数据处理方法的飞速发展为解析类GPCR家族其他成员的结构提供了范例,促进了味觉和感官生物学领域的整体进步。总结来看,人类甜味受体的结构与功能特征的解析不仅丰富了我们对味觉感知机制的理解,也为食品科学、营养学和药物开发领域开辟了新的方向。未来,通过结合结构生物学、分子药理学及生理学研究,有望实现针对甜味感知途径的精准调控,改善人类饮食健康水平。