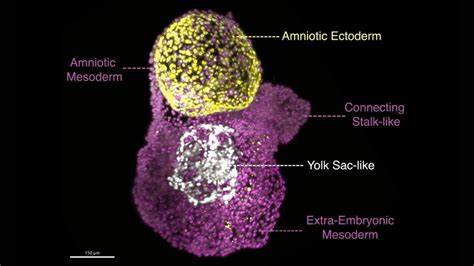
近年来,科学界对早期人类胚胎发育阶段的研究受到极大关注,尤其是关注胚胎周围支持组织——羊膜囊的形成与功能。羊膜囊作为包裹并保护胚胎的薄膜结构,在胚胎发育的前几周发挥着至关重要的作用。它内含的羊水不仅为胚胎提供缓冲保护,还参与调控胚胎周围环境的细胞信号和营养交换。尽管其重要性不言而喻,因人体内孕早期阶段的研究限制和伦理挑战,科学家们长期以来难以深入窥探其细节。近期,利用干细胞成功培育迷你羊膜囊模型的突破则为这一难题带来了曙光。 来自伦敦弗朗西斯·克里克研究所的科学家Silvia Santos及其团队通过创新的细胞培养技术,诱导人类胚胎干细胞形成被称为“后胚层羊膜体”(Post-Gastrulation Amnioids,PGAs)的模型。
这一模型精准模拟了人类受精后两至四周羊膜囊的结构和功能,成为迄今为止最先进、最成熟的羊膜囊体外模型。PGAs不仅形态上接近真实羊膜囊大小,甚至能够在实验条件下维持三个月以上的生存周期,这大大超过了之前模型几天的培育寿命限制。 在实验室中,这些迷你羊膜囊展现了两层明显区别的细胞构造:内层为羊膜内胚层,外层为胚外中胚层,中央则充满模拟羊水的液体空间。Santos团队通过对胚胎干细胞依次添加特定信号分子BMP4和CHIR,成功诱导细胞自行组织形成这一结构。此过程充分体现了干细胞在适宜条件下惊人的自组装和分化能力。更令人惊叹的是,研究发现基因调控者GATA3在羊膜囊形成过程中扮演关键角色,其能够单独驱动干细胞向羊膜囊方向分化,这一发现促进了对分子机制的深入理解。
羊膜囊作为支持胚胎生长的关键组织,不仅为胚胎提供物理保护,还具有强大的抗菌和抗炎特性。事实上,临床上部分剖宫产产妇自愿捐献的羊膜组织已被用于烧伤患者的创面覆盖和眼科角膜修复,但现有捐献材料的异质性和供应不稳定,一直是限制大规模应用的瓶颈。PGAs提供了一个几乎无限可控、标准化的细胞来源,未来有望成为可替代蛯捐羊膜材料的新型疗法,极大提升再生医学和组织工程的临床转化效率。 此外,PGAs也可用于深入研究胚胎发育早期的健康与疾病机制。部分先天性畸形与羊膜囊的发育异常和容量变化密切相关,但目前尚缺乏有效体外模型验证。通过对PGAs进行基因敲除或基因编辑,科学家能够模拟不同病理状态,探索异常发育背后的细胞和分子机制,这不仅有助于提高产前诊断的准确性,还可能开辟预防和治疗先天疾病的新路径。
学界还对PGAs潜在的个体化医疗前景表现出极大兴趣。理论上,从患者体细胞逆转为诱导多能干细胞(iPSCs),再转化为PGAs,能够生成与患者完全匹配的羊膜细胞系,避免移植后免疫排斥。这为未来个性化医疗和细胞疗法提供了宝贵工具,提升了治疗复杂疾病的可能性。此外,该系统亦可用于筛选妊娠早期可能的药物毒性反应,保障用药安全。 除医疗应用外,这一羊膜囊模型还能为基础科学研究提供坚实支撑。以前对人类胚胎早期阶段的研究主要依赖动物模型或有限的人体样本,难以准确反映人类特异性的复杂发育过程。
PGAs突破了这一局限,使科学家得以观察细胞在自然组织环境中如何互动、分化及信号传递,进一步揭示人类独有的胚胎发育规律。 未来,随着相关培养技术与基因编辑手段的不断进步,PGAs或将与类器官、类胚胎模型相结合,构建更为完整和复杂的人体胚胎发育模拟平台。这将大幅加速再生医学、发育生物学和药物研发的进程,推动精准医疗和干细胞疗法的临床应用。 总的来说,利用干细胞在实验室中构建迷你羊膜囊模型代表了生命科学领域的一项重大突破。这不仅为研究人类胚胎早期关键阶段提供全新视角,也为临床治疗及生物医药产业开辟了广阔前景。随着科学家不断完善并深入挖掘其潜能,迷你羊膜囊必将成为未来生命医学研究和应用的重要基石,助力人类更好地认识生命起源、改善健康和延长寿命。
。