口腔并非孤立的生态系统,而是一个充满微生物、化学信号与动态相互作用的复杂小宇宙。越来越多研究表明,除了细菌种群结构外,微生物所产生的专用代谢物在决定健康或疾病命运方面扮演着关键角色。在牙齿龋坏(牙齿蛀洞)的生成过程中,生物膜的形成与结构密度直接影响酸性环境的维持与牙釉质的脱矿。最新研究发现,一类来自变异链球菌(Streptococcus mutans)和其他口腔菌属的非典型天然产物以双分子协同模式促进强韧的生物膜形成,为理解口腔致病机制与开发新型防龋策略提供了新的视角。本文将系统解析这一发现的来龙去脉、生物合成学背景、作用机制及其临床与生态学意义,并讨论未来研究与应用方向。 口腔微生物组、专用代谢物与牙龋之间的联系近年来,宏基因组与转录组技术推动了对口腔微生物基因多样性的深入认识。
单一物种内存在大量可变基因组(pangenome)的事实意味着不同菌株可能通过携带特定生物合成基因簇(biosynthetic gene clusters, BGCs)产生不同的代谢产物,从而显著改变其生态位与致病性。变异链球菌作为典型的致龋菌,其不同菌株表现出明显的致龋能力差异,这与其产生的粘附因子、酸耐受性以及代谢产物密切相关。专用代谢物,例如某些多肽、脂肽或聚酮-非核糖体肽类(PKS-NRPS)衍生物,能改变细胞表面物理化学性质、促进细胞间粘附或调控群体行为,从而影响生物膜的形成与稳定性。 基因组驱动的代谢物筛选与mcg基因簇的识别通过将宏基因组/宏转录组数据与已知或预测的BGC序列比对,研究者能够在复杂样本中定位与疾病状态相关的基因簇。在多组人群牙菌斑的宏基因组与宏转录组数据中,一个被命名为mcg的PKS-NRPS杂交基因簇在龋患样本中出现频率和表达量显著偏高。进一步的基因组挖掘显示,mcg在多株S. mutans中分布广泛,并且在其他口腔相关菌属中也能找到同源结构,暗示其在口腔生态位可能具有重要功能。
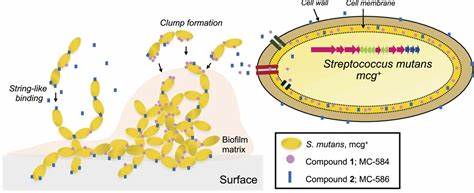
从基因簇到分子:发现并解析mutanoclumpins 基于基因敲除与比较代谢组学方法,研究团队在携带mcg基因簇的S. mutans野生株与相应敲除株之间对比,鉴定出两种主要的代谢产物,质量数分别为约584和586(以[M+H]+呈现),统称为mutanoclumpins。通过放大培养、分离纯化与高分辨质谱、核磁共振(NMR)分析,这两种物质被确定为结构上相似却存在关键差别的脂肽类分子:一类为带有C-C大环连接的"宏环"型(常称MC-584),另一类为线性或开放链结构(常称MC-586),另有少量羟基化衍生物被检出。尽管两者来自同一条PKS-NRPS装配线,但最终的分子支路明显截然不同,这在天然产物生物合成中不常见。 分子合成逻辑:PKS-NRPS装配线的分化与终端释放域的作用mcg基因簇编码典型的脂酰激活酶、PKS模块、NRPS模块以及修饰酶等。生物合成起始于脂肪酸底物的加载,随后通过酮合与氨基酸(例如苯丙氨酸和谷氨酸)的并入形成中间链。一个关键的非典型步骤是通过γ-羧基而非常见的α-羧基来参与缩合并随后被甲基化修饰。
研究者通过同位素标记的丝氨酸供体喂养实验与质谱、13C-NMR追踪,提出了一条分支化的化学转化路径。终端的还原酶(R域)在释放中间产物时可能先生成醛,再发生内源性醛-酮或醛-烯类的重排/环化反应,形成五元内酰胺(2-吡咯酮)结构。随后,从共同前体通过是否发生迈克尔加成与一系列两电子或四电子还原,最终产生宏环或线性两类产物。这种由同一装配线产出两种结构截然不同主要产物的现象,强调了终端催化域在产物谱决定中的复杂角色。 双分子协同促进生物膜:不同定位、不同形态带来互补性功能功能性实验显示,mcg基因簇与强生物膜形成呈正相关。针对mcg敲除株的化学补救实验表明,单独补充任一纯化产物(MC-584或MC-586)均不能显著恢复野生株水平的生物膜形成,只有两者联合补充才能重新建立稳定、耐洗涤的三维生物膜结构。
显微观察揭示两种分子在细胞表面的结合与诱导形态完全不同:MC-584倾向于牢固吸附并嵌入细胞膜,引发细胞形成密集的三维团聚体;MC-586既结合到细胞壁也分布于膜上,促使细胞排列成更长的链状结构。两种不同的物理影响在空间上互补,MC-584增强聚集与局部密度,MC-586延伸细胞链并连接微群落,二者协同产生更为稳固且酸性更集中的生物膜微环境,这正有利于牙釉质脱矿与龋病进展。 非信号调控而是物理化学驱动的生物膜形成RNA-seq分析显示,mcg敲除并未显著改变S. mutans众所周知的主要生物膜相关基因表达,例如负责糖基化合物合成与胞外多糖产物的关键基因没有被大幅调控。这意味着mutanoclumpins更可能以物理化学方式直接改变细胞表面性质与细胞间相互作用,而非通过典型的信号调控通路诱导基因表达的级联变化。两种分子可被有机溶剂提取回收,且在细胞表面为非共价结合,提示其作用机制涉及疏水相互作用与表面自组装行为,这与已知某些天然脂肽或生物表面活性物质的作用模式相似。 对口腔生态的潜在影响与物种间互作实验证据显示,mutanoclumpins不仅影响S. mutans自身的生物膜特性,还能部分调节其他常见口腔菌种的生物膜形成。
例如,对某些早期定植菌种(如S. sanguinis)可能抑制其生物膜,降低其竞争力;而对另一些物种则可能增强生物膜发展。这样的物种选择性效应有助于S. mutans在多物种社区中建立并维持致龋优势位点,从而促进龋病环境的形成。 临床与防治意义mcg及其产物的发现为口腔健康管理与龋病预防提供了新的分子级目标。首先,mcg基因簇或mutanoclumpin的存在与表达可望成为早期风险预测的分子标志物,结合宏基因组或代谢物检测技术,有望在龋病发生前识别高风险个体。其次,针对mutanoclumpins的合成路径或关键酶(例如终端R域、脂酰激活酶或特定甲基转移酶)进行药物抑制,理论上可以削弱S. mutans形成稳固生物膜的能力,从而降低致龋性。此外,从生态学角度出发,可探索通过促进竞争性非致龋菌种或引入分子拮抗剂来改造口腔微生态,实现预防性干预。
技术挑战与未来研究方向尽管研究已经揭示了mcg及其产物的核心特性,但许多关键问题仍需解答。首先,对于终端R域如何在催化过程中分配迈克尔加成与直接还原的化学命运,需要通过体外酶学、结构生物学与定量同位素示踪的组合研究来解析。其次,mutanoclumpins具体与哪些细胞表面分子发生物理相互作用、其自组装的纳米结构与力学特性,需借助高分辨显微、表面物理学与生物材料学手段研究。再次,体口腔或动物模型中mutanoclumpins对多物种生物膜空间构型与酸度梯度的长期影响值得深入探索,以评估其在牙釉质脱矿与临床龋变形成中的直接贡献。最后,从应用角度,需评估抑制或中和这类代谢物的可行策略对微生物群落平衡与宿主安全性的长远影响。 研发前景:从分子靶向到微生态干预基于当前发现,未来可展开多条转化路径。
小分子抑制剂或抗体样结合体针对关键合成酶或产物本身或可减少mutanoclumpin水平,从而干预致龋生物膜的形成。替代策略包括设计功能化牙膏或漱口液,含有能结合并中和MC-584/MC-586的分子,阻断其对细胞表面的吸附。更为宏观的策略是通过益生菌或生态调节剂,提升早期定植菌或其他拮抗菌的相对丰度,改变群落结构,降低mcg阳性S. mutans的竞争优势。 结语对口腔健康的维护已不再是单纯清洁牙齿与限糖问题,微生物代谢组学的进展让人们开始理解微小分子如何塑造微生物行为与宿主疾病风险。mcg基因簇与其产物mutanoclumpins的发现,展示了微生物通过合成两种截然不同且功能互补的小分子,来实现对群体组织与生态位构建的精准控制。揭示这种罕见的双分子协同策略,不仅丰富了对口腔微生物功能的理解,也为牙龋的早期预测和创新干预提供了有力线索。
未来跨学科的研究将把代谢化学、酶学、微生物生态学与临床口腔医学结合,朝着以机制为导向的个性化牙齿预防与治疗迈进。 。