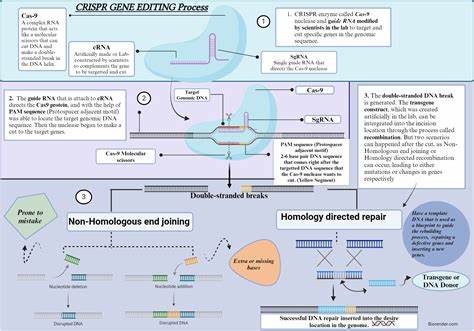
近年来,基因编辑技术以惊人的速度发展,逐渐从实验室研究走向临床应用,成为现代医学的一大突破。尤其是对于罕见遗传病和体内代谢错误,传统医疗手段往往无能为力,而基因编辑治疗则为患者带来了新的希望。本文将全面介绍基因编辑治疗的科学原理,解析相关技术的优势与挑战,探讨个体化基因疗法的开发流程,并展望这一领域的未来发展趋势。基因编辑是一种通过人工操控生物体内基因序列,实现基因删除、插入和替换的技术。最为广泛应用的技术包括CRISPR-Cas9系统、碱基编辑器和Prime编辑器等。其中,CRISPR-Cas9技术因其高效简便、成本低廉的特点,成为基因组工程的“瑞士军刀”。
同时,碱基编辑器作为一种能够在不引入双链断裂的情况下,实现单个碱基精确转换的新型工具,有效降低了基因编辑过程中的脱靶风险与细胞毒性。基因编辑技术的核心在于精准定位目标基因位点,随后通过酶切和修复机制完成基因序列的修改。细胞内的DNA修复系统主要依赖非同源末端连接(NHEJ)和同源重组(HDR)两类途径。通过优化编辑工具与细胞条件,科学家们能够提高编辑效率和准确度,最大程度减少潜在不良反应。罕见遗传病因某些基因突变导致蛋白质功能异常或缺失,典型例子如婴儿KJ患有的某种代谢性遗传病。过去,由于对疾病分子机制的缺乏了解和治疗手段的限制,患者常常面临不可逆的组织损伤和生命危险。
然而,凭借基因编辑技术,医生与研究者能够针对个体患者的突变基因,开发“n-of-1”个体化治疗方案,即为单个患者定制基因编辑疗法,从根本上纠正致病基因变异,实现临床治愈的可能。从研发流程来看,首先需通过高通量测序和生物信息学分析确认患者致病基因和突变类型。其次设计并筛选高特异性、高效率的编辑工具,如合成单导RNA(sgRNA)或碱基编辑酶。然后在体外细胞模型中验证编辑效果和安全性,确保无明显脱靶效应。最后通过动物模型进行疗效和安全性评估,获得监管机构批准后,方可启动临床试验。整个流程强调速度与质量的兼顾,使得从基因鉴定到临床用药周期大幅缩短,最大限度避免病情恶化。
基因编辑治疗的潜力不仅在于单基因病的修复,还能应用于癌症免疫治疗、HIV病毒清除以及复杂多基因疾病的疗效提升。与此同时,技术自身也在不断进化。新一代基因编辑工具追求更高的精准度、更低的副作用以及更便捷的递送方式。值得关注的是,合成生物学和人工智能技术的融合,将极大加速基因编辑工具的设计与优化,助力个性化基因疗法实现规模化推广。然而,基因编辑治疗尚面临伦理、法律和社会层面的诸多挑战。例如,如何界定编辑人类胚胎基因的底线,避免“设计婴儿”的风险与滥用;如何保障患者知情同意和隐私安全;如何在全球范围实现公平的技术普及和医疗资源分配等。
这些问题需要科学家、政策制定者、伦理学家和公众积极参与讨论。基因编辑技术的推广应用,也需要建立完善的法规体系和监管机制,确保科学创新的同时,守护人类健康和社会价值。总结来看,基因编辑治疗代表了现代医学的一场革命。通过精准靶向致病基因,个性化地赋予罕见病患者治疗新机遇,推动整体医学从治标走向治本。未来,随着技术的不断进步和多学科的深度融合,基因编辑将广泛应用于更多疾病领域,促进医学极大飞跃。公众对该技术的认知提升与政策法规的完善同样重要,是推动这一新兴治疗手段安全、高效落地的关键。
面对疾病挑战,人类正迎来前所未有的技术红利和生命希望。基因编辑治疗为医疗健康书写了崭新篇章,也让我们重新定义疾病治疗和生命科学的可能性。