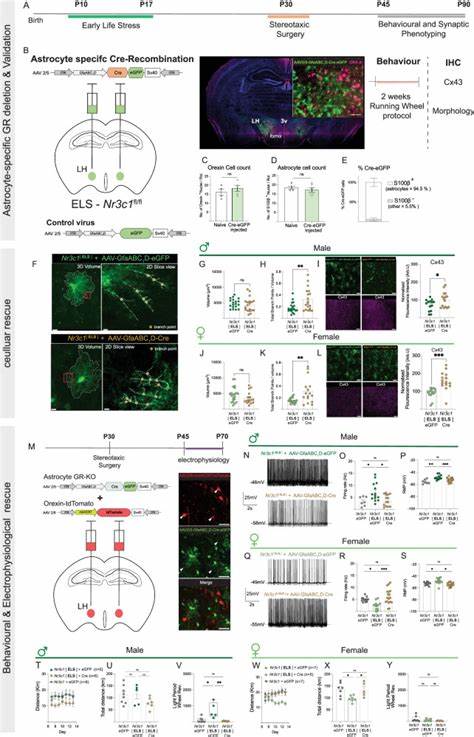
应激反应是生物体面对外界威胁时启动的一系列复杂生理及行为变化,对于维护生命体适应环境起着至关重要的作用。然而,过度或慢性的应激负荷常会导致中枢神经系统功能紊乱,进而产生一系列情绪障碍及神经精神疾病,如抑郁症、焦虑症及睡眠障碍。近年来,神经科学领域的研究目光逐渐从单纯聚焦神经元转向了神经胶质细胞,尤其是星形胶质细胞(astrocytes),这一辅助但不可或缺的细胞类型被发现不仅支持神经元的代谢需求,还参与调节神经自身的活动及行为表现。针对星形胶质细胞在应激反应中的作用,科学家们通过性别差异的视角,揭示了雄性和雌性个体对相同早期生活应激刺激展现出的截然不同的神经细胞和行为反应模式。早期生活应激(Early Life Stress,简称ELS)是研究神经发育异常以及情绪障碍的经典动物模型之一,模拟人类童年期的逆境与压力。通过对小鼠模型的系统分析,研究发现,ELS不仅导致雄性和雌性小鼠血液中糖皮质激素水平显著升高,还引发了与血糖皮质激素波动同步的昼夜活动节律紊乱。
雄性小鼠表现为昼间活动水平异常提升,而雌性则在夜间展现出活动减少,这种活动节律的差异性受到下丘脑外侧区星形胶质细胞反应的调控。众所周知,下丘脑外侧区内的升主动脉素/神经肽体(orexin/hypocretin)神经元具有调节觉醒状态和代谢活动的重要功能。它们的自发神经放电在保持正常的昼夜节律与运动行为中起到了核心作用。研究通过基因病毒标记及膜片钳技术揭示,ELS导致雄性小鼠的升主动脉素神经元自发放电率明显增加,与之相匹配的是昼间活动过度活跃的行为表现;而在雌性小鼠,升主动脉素神经元自发放电率显著降低,伴随夜间活动的减少。细胞机制层面,星形胶质细胞在调节神经元兴奋性中扮演了中心角色。ELS后,雄性星形胶质细胞的形态重塑伴随其 purinergic 信号通路的增强,促使ATP及其衍生物在神经元突触微环境中的浓度上升,这通过激活神经元的P2X受体,显著提高升主动脉素神经元的兴奋性,导致雄性小鼠昼间行为活跃增加。
相比之下,雌性星形胶质细胞在应激条件下则表现出 L-乳酸供应的缺失,特别是星形胶质细胞中连接蛋白43(Connexin-43,Cx43)表达减少,削弱了细胞间的能量代谢耦合,导致升主动脉素神经元能量支持不足,反映在其放电频率的降低及雌性小鼠夜间活动减少上。在分子调控机制上,星形胶质细胞糖皮质激素受体(glucocorticoid receptors,GR)介导了其对应激的响应。通过运用基因敲除技术特异性删除下丘脑外侧星形胶质细胞中的GR,实验成功地恢复了因ELS诱发的星形胶质细胞形态改变及其功能障碍,同时调整了升主动脉素神经元的自发放电频率,使雄性和雌性小鼠的活动水平趋于正常。这一发现提出,星形胶质细胞的GR信号通路是连接早期应激与神经活动及行为改变的关键枢纽。基于该发现,星形胶质细胞被重新定义为应激相关神经行为调控中的主动参与者,而非传统上被视为被动的神经元支持细胞。星形胶质细胞不仅能通过释放代谢物和神经递质优先调节局部神经元群的活性,还能根据性别差异调节细胞内信号转导路径,产生较为复杂的网络效应,进而解释为何相同的应激暴露在不同性别个体上会产生截然不同的行为结果。
该研究的临床启示亦不可忽视。许多精神疾病展现出明显的性别差异性发病率和症状表达,理解星形胶质细胞在性别特异性神经调控机制中的角色,有助于开发更为精准的治疗策略。例如,针对雄性患者可能更适合调节 purinergic 受体介导的兴奋性通路,而雌性患者则需关注神经元能量代谢通路及其辅佐细胞的功能优化。近年来,星形胶质细胞在脑能量代谢、神经免疫调节及神经递质稳态中的作用已被广泛认可,其异常参与是多种神经精神疾病如抑郁、焦虑及神经退行性疾病的重要发病机制。ELS作为一种诱发长期认知与行为异常的模型,其引导的星形胶质细胞形态及代谢功能的改变,为揭示广泛病理状态下胶质细胞参与机制提供了重要范本。未来的研究可进一步探讨应激引起的星形胶质细胞下游信号通路及其与神经元、微胶质细胞之间的跨细胞互动,尤其是在不同性别及发育时期的比较研究,以完善多细胞网络的系统理解。
此外,细胞内钙信号在星形胶质细胞中的角色也备受关注。实验通过高效腺相关病毒介导的化学遗传学激活,增强星形胶质细胞Gq蛋白偶联受体的钙信号,可人为激发神经元群活动,模拟应激状态下的功能变化,提示在分子调控层面,星形胶质细胞钙信号为连接外界环境刺激与神经元行为响应的重要桥梁。与此同时,针对星形胶质细胞代谢网络的损伤,尤其是C x43介导的胞间连接及L-乳酸供给通路的保护,成为预防和治疗应激相关神经精神疾病的新兴靶点。总之,通过对性别差异的细致分析,此项研究深刻揭示了早期生活应激如何通过激活星形胶质细胞不同的信号通路,改变下丘脑外侧区升主动脉素神经元的放电功能,进而调控小鼠的昼夜活动节律。星形胶质细胞不仅在维持脑功能稳态中占据核心地位,同时其对激素信号的敏感性和多重功能使其成为理解神经精神疾病发生机制的关键。针对这一细胞类型的精准干预,有望为性别特异性的神经疾病治疗开辟新路径。
。