阿尔茨海默病作为神经退行性疾病中的主流代表,其发病机制长期以来吸引了大量科学家的关注。尤其是在过去几十年中,围绕阿尔茨海默病的致病路径,科学界逐渐形成了以“淀粉样蛋白级联假说”为核心的研究框架。然而,即便该假说在学术界处于显著主导地位,近年来关于这一假设的质疑和反思也日益频繁。探究这些争议的根源,加深对疾病模型构建的理解,对于推动学科进步至关重要。本文将聚焦于1995年发表在权威期刊Nature上的一篇具有里程碑意义的研究,该研究首次成功开发了转基因小鼠模型(PDAPP小鼠),这成为阿尔茨海默病研究的重要突破,同时也揭示了该领域的多重挑战和科学方法的复杂性。科学论文的结构通常强调逻辑清晰的假设提出、方法实施以及结果论证,给人一种科学探索流程严格有序的印象。
然而,诺贝尔奖得主彼得·梅德沃(Sir Peter Medawar)的观点提醒我们,这种清晰有时候只是表象。实际的科学过程往往杂乱无章,研究者们在实验方法、数据解读与思路调整之间反复“摸索”,论文中所呈现的故事可能是对复杂经历的高度简化与美化。在转基因小鼠的创建过程中,这种“科学的魔法”尤为显著。1990年代,利用分子生物学技术将人类突变APP基因植入小鼠基因组,是一项极其艰难而繁琐的技术挑战。研究团队需要设计精准的DNA构建体,将各类基因元件巧妙组合,以实现在人脑神经元中高效、稳定表达该基因。由于转基因拷贝数及插入基因组位置随机,表达量控制成本极高。
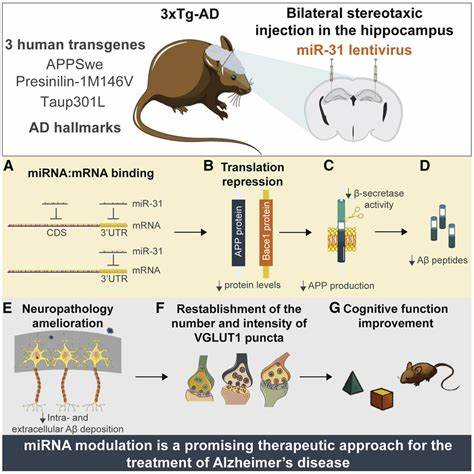
更关键的是,如何保证产生的人类蛋白产物在功能与代谢水平上模拟真实的人类条件,是这项工作的核心难点。PDAPP小鼠的成功之处在于它能过度表达含有V717F突变的APP,导致脑内出现类似于人类阿尔茨海默病的淀粉样斑块。然而,高达40个拷贝的APP转基因过度表达,远超过正常人仅有的2个拷贝,给模型的生理真实性带来质疑。蛋白质过度堆积本身可能诱发非特异性神经毒性,难以区分由特定病理过程引发的机理。除蛋白质表达水平问题外,模型的另一个关键短板是未能表现出阿尔茨海默典型的另一主要病理特征——神经纤维缠结(神经元内部tau蛋白异常聚集)。这一局限直接影响了该模型在复制人类疾病全貌方面的有效性。
即使斑块数量增加,神经纤维缠结的缺失意味着小鼠大脑缺少了与认知功能下降最相关的分子事件。对于认知功能的评估,初期PDAPP模型的研究尚缺乏足够行为学数据,这又使得模型的临床相关性受到限制。科学评价该研究时,不能仅止于赞赏其技术突破,而应结合严格的实验设计原则。要验证淀粉样蛋白的病理学主导作用,需证实其时间先后顺序及因果关系,即斑块出现应先于神经损伤与认知障碍;此外还需证明淀粉样蛋白的存在对疾病发展是必要且足够的。遗憾的是,PDAPP小鼠模型在这些方面的表现并不尽如人意。研究人员在制备模型时也面临巨大不确定性,从胚胎微注射、基因组整合到后续表型筛选,每一步都充满变量与失败概率。
如此复杂且高度依赖实验者经验的过程决定了科学报告往往只能呈现“完美”的最终成果,而忽略了实验背后漫长的试错历程。回溯至该标志性研究的历史背景,科研及药企对淀粉样蛋白假说的期待极高,认为若能成功阻断淀粉样蛋白形成,有望带来治愈阿尔茨海默病的革命性疗法。于是PDAPP鼠标模型不仅引发了学界轰动,也成为了制药产业投资的焦点。然而,随后的数十年中基于该模型开发的药物多次临床失败,投入数十亿美元的研究资金几近付诸东流。尤其在2021年,FDA对辉瑞与Biogen开发的多款抗淀粉样蛋白药物的审批过程备受争议,部分原因是疗效数据不足以支撑其临床推广。这些事件暴露了科学研究与监管之间、商业利益与科学严谨间的紧张关系。
值得关注的是,近年来有针对某些关键研究数据造假的调查出现,让淀粉样蛋白领域的整体信任度进一步受挫。面对模型和疗法的不足,不同科学团体也提出了多种阿尔茨海默病的替代理论,比如tau蛋白假说、代谢紊乱及神经炎症等。虽然这些观点尚未形成统一主流,但其出现拓宽了疾病认识的视角。科学界也渐渐意识到,单一因果假说难以全面解释复杂脑疾的多层次病理变化,未来需要更系统的多路径整合研究。总结来看,PDAPP小鼠模型的诞生无疑是医学研究史上的里程碑,它为阿尔茨海默病探索提供了强有力的技术工具和早期经验。与此同时,该模型自身的限制和衍生问题也提醒我们:科学研究需要摒弃叙事化的表面故事,更多关注实验数据背后的细节、假设的严谨性以及替代理论的可能性。
在大众高度关注的医疗领域,保持开放、批判和多元的态度,是推动疾病理解和治疗进展的关键。未来,随着基因编辑、单细胞分析和人工智能等先进技术的普及,更加精准和复杂的疾病模型将出现,为破解阿尔茨海默病等重大难题注入新的希望。