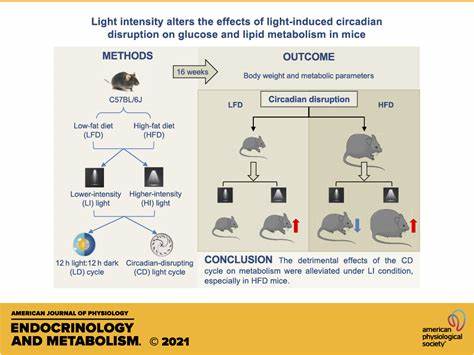
疼痛作为一种复杂的感觉和情绪体验,广泛影响人类和动物的生活质量。炎症性疼痛,尤其在慢性疼痛症状中表现突出,不仅引发局部的不适和机体功能障碍,还深刻干扰睡眠模式和昼夜节律。近年来,科学家们利用小鼠模型,特别是采用完全弗氏佐剂(Complete Freund's Adjuvant, CFA)诱导的炎症性疼痛,系统研究了疼痛与睡眠之间的联系,为理解疼痛引起的睡眠障碍及其治疗提供了重要线索。CFA注射在小鼠后肢引发的炎症反应,伴随持续的机械性过敏和肢体肿胀,具体表现为睡眠结构的昼夜节律依赖性改变。实验显示,炎症性疼痛显著增加了小鼠在暗相(活跃期)的睡眠总时长,而在明相(休息期)则表现出睡眠片段化,即睡眠持续时间缩短,清醒状态破碎性增加。这种睡眠形态的变化表明,疼痛在昼夜活动周期中调节睡眠的机制是动态且复杂的。
利用无线脑电图(EEG)和肌电图(EMG)技术,研究团队进一步揭示了炎症性疼痛对快速眼动睡眠(REM)和慢波睡眠(SWS)的显著影响。特别是在小鼠的暗期,REM和SWS的持续时间和整体场次数量均明显增加,伴随觉醒持续时间下降,表明疼痛可能通过促进睡眠阶段的转变,实现对疼痛感知的调节。此外,疼痛引起的睡眠变化在性别上表现出一定差异,部分参数中雌性小鼠对疼痛诱导的睡眠模式改变更加敏感,这与人类慢性疼痛和睡眠障碍中观察到的性别差异不谋而合。研究还指出,虽然小鼠的整体昼夜节律受到注射应激的短暂干扰,炎症本身并未对内源性的生物钟节律产生显著破坏,意味着疼痛与睡眠的交互更多体现在睡眠结构和觉醒模式的调整,而非节律周期的改变。这一发现为未来开发针对疼痛相关睡眠障碍的治疗策略提供了重要依据。疼痛与情绪状态的相互作用机制同样丰富且复杂。
炎症性疼痛作为持续性应激源,通过激活下丘脑-垂体-肾上腺轴和中脑边缘多巴胺系统,可能导致负面情绪如焦虑和抑郁,这些状态反过来又加剧睡眠质量的下降。相关研究证实,疼痛与心理压力共享部分神经环路,并且促炎因子(如IL-1β、IL-6和TNF-α)在调控睡眠和情绪中扮演关键角色,这些分子的表达具有日夜节律性,且受疼痛和应激影响。驱动疼痛感知的神经元群体,如伏隔核内的多巴胺受体阳性介导通路,不仅影响动机和奖赏,还调节睡眠与觉醒。通过操控这些神经元的活动状态,学者们发现能够部分逆转疼痛诱导的睡眠剥夺和行为功能障碍,提示疼痛相关睡眠改变可能具有一定的适应性和保护性。炎症性疼痛还与体温调节的变化密切相关。实验发现,炎症诱发的小鼠体温在不同光照周期下表现出相反的调节效应,光相注射时体温下降而暗相注射时体温上升,这种现象暗示疼痛与昼夜生理调节机制之间存在尚待进一步解析的联系。
体温作为影响睡眠深度和结构的重要生理信号,也可能通过调节疼痛感受性,深化疼痛-睡眠的互作。临床上,慢性炎症性疼痛症候如类风湿关节炎和纤维肌痛症患者常报告睡眠断续、疲劳和白天嗜睡,类似于动物模型所见的睡眠片段化和睡眠增加,这进一步支持小鼠CFA模型的转译效度。疼痛与睡眠障碍的相互作用构成恶性循环,睡眠缺失能增强疼痛感知,而疼痛反过来扰乱睡眠,形成持续的负反馈。针对这一机制,改善睡眠质量已成为临床疼痛管理的重要方向之一。当前的研究成果对未来发展睡眠阶段特异性药物治疗策略具有指导意义,例如针对REM或SWS的调节,或者通过神经调控技术精准介入相关脑区以提升睡眠稳定性和减少疼痛性觉醒。此外,检测个体睡眠特征,利用夜间监测数据作为疼痛管理和预测的生物标志,也正在兴起。
随着可穿戴设备和日常数字健康工具的广泛应用,实时睡眠监测为评估疼痛患者的生活质量和治疗反应提供了客观数据支持。小鼠模型的成功应用展示了动物行为学与神经生理学测量相结合的重要性,为理解炎症性疼痛引起的睡眠变化机制奠定坚实基础。未来研究应聚焦于炎症因子如何在关键睡眠调控脑区中发挥作用,同时探索性别、时间因素对发病机制的影响。归根结底,提高睡眠的连续性和质量对于缓解炎症性疼痛的负面影响、改善患者生活质量具有潜在的临床意义。炎症性疼痛的昼夜节律依赖性睡眠影响揭示了疼痛管理和睡眠医学交叉领域的新视角,激励科学家们继续探索疼痛、免疫系统及神经生理之间的复杂交互,推动精准医学的发展。 。