艾滋病毒(HIV)的潜伏感染一直是阻碍其根治的最大障碍。 尽管现有抗逆转录病毒疗法(ART)能够有效抑制病毒复制,延长患者生命,但无法根除潜伏在静息CD4+ T细胞中的整合病毒基因组。 这些潜藏的病毒一旦T细胞被激活,便能重新启动复制,导致病毒反弹,必须终身服药维持抑制。 因此,寻找能够有效靶向并激活潜伏病毒的策略为实现治愈带来了新的希望。 随着mRNA和脂质纳米颗粒(LNP)传递技术的飞速发展,科学家们正在研发新型治疗手段,通过高效递送mRNA,实现对静息T细胞内潜伏HIV的唤醒,推动“唤醒并清除”策略的临床转化。 静息T细胞本身对基因递送极为抵触,传统方法效率低、细胞毒性高。
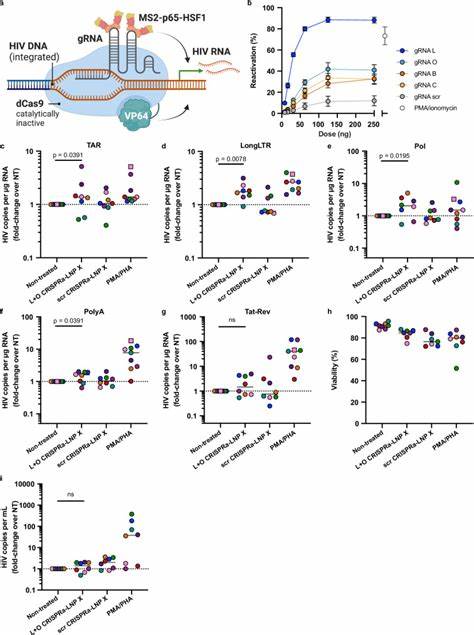
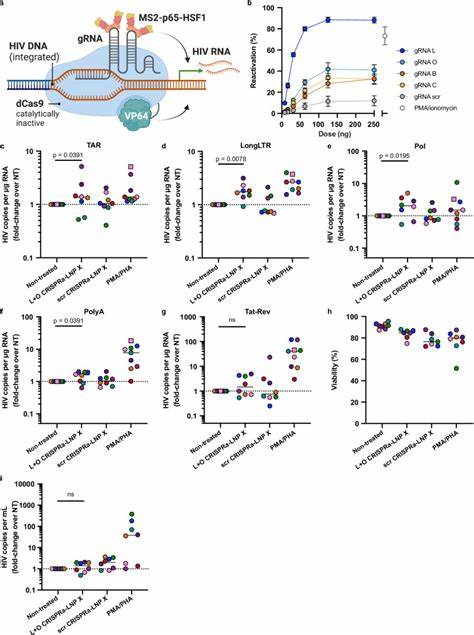
最新研究通过改良脂质纳米颗粒配方,尤其采用SM-102离子化脂质结合β-植物甾醇的组合,打造出一种称为LNP X的纳米载体,具备强大穿透静息CD4+ T细胞膜的能力,同时保持极低的细胞毒性和不会引发细胞激活。 LNP X的核心优势在于其能够高效且温和地将编码HIV转录激活蛋白Tat的mRNA包裹并递送入细胞质,远超传统基因递送平台,实现了潜伏病毒的高效激活。 HIV Tat蛋白作为病毒转录的重要调控因子,通过与病毒RNA中的转录激活反应元素(TAR)结合,增强RNA聚合酶Ⅱ的过程性,促进病毒基因组的完整转录。 以往虽有尝试使用Tat蛋白或其编码基因刺激潜伏病毒,但主要受限于递送效率低和非特异性活化导致的不良反应。 LNP X的平台不仅能将Tat mRNA成功导入静息T细胞,还能达到比经典的强刺激剂PMA和PHA更显著的潜伏病毒转录激活,同时避免T细胞全身性激活,降低潜在免疫副作用。 这一点对于临床应用具有重要意义,因为过度激活免疫系统可能引发炎症和非特异性免疫排斥。
除了Tat mRNA,LNP X还展示了高效递送多组分CRISPR激活系统(CRISPRa)的能力。 该系统通过无切割活性的Cas9融合转录激活因子,结合引导RNA特异性定位至HIV长末端重复序列(LTR)特定启动子区域,实现病毒基因的选择性增强表达。 研究表明,利用LNP X联合递送CRISPRa的各个RNA组分,可以在静息T细胞中实现靶向激活内源性基因,譬如CD25,证明这种方法不需细胞激活即可产生功能性蛋白表达。 CRISPRa-LNP X在静息T细胞中成功促进了潜伏病毒转录的多级激活,表明未来有望开发更精准、高效且副作用低的潜伏病毒干预策略。 探索LNP X的作用机理揭示,其卓越的转染效率并非单纯依赖于内吞体逃逸能力的提升,而是在细胞表面和细胞内结合的提升以及mRNA的翻译效率上。 这一发现为纳米颗粒设计提供了重要参考,未来改进可着重提升细胞摄取和细胞内mRNA稳定性,实现更高蛋白产量。
此外,LNP X对T细胞亚群如初始单元和不同记忆T细胞均具备传递能力,确保对广泛潜伏细胞群的覆盖。 在免疫细胞共培养体系中,LNP X对CD4+ T细胞的靶向性良好,但对单核细胞也存在一定传递,提示未来可通过修饰LNP表面靶向配体提升专属性和体内靶向效率。 尽管Tat-LNP X能激活潜伏病毒使其表达病毒RNA和蛋白,单次处理并未显著减少整合病毒DNA,反映潜伏细胞依赖多种机制维持存活,需结合细胞凋亡诱导或免疫清除手段实现“杀死”阶段。 这也与已知潜伏细胞表达BCL-2和BIRC5等抑制凋亡蛋白一致,表明多靶点组合策略将更有效。 科学界普遍认识到仅靠激活潜伏病毒不足以清除感染细胞,改进潜伏逆转剂的特异性、降低免疫抑制作用、并增强效应细胞杀伤能力方为根本。 LNP X作为一种高效mRNA递送平台,为基因治疗和免疫治疗提供了强劲技术支撑,有望将CRISPR基因编辑技术和其他基因调控工具成功应用于HIV治疗。
例如,联合CRISPR-Cas9精准敲除HIV基因组或编辑CCR5受体以阻断病毒入侵细胞,都具备高度临床转化潜力。 在未来的研究中,需系统评估LNP X在体内分布、免疫反应及毒理学表现。 人体中LNP剂量安全区间已有初步数据支持,但针对静息T细胞的定向递送及免疫耐受机制,仍需深入探索。 精准靶向LNP附加特异性配体,增强对T细胞的选择性摄取,将有效提升治疗窗口,减少非靶细胞影响。 同时,深入分析LNP介导基因调控对T细胞转录组和代谢组的长远影响,对于免疫稳态及潜伏病毒管理至关重要。 从治疗策略层面看,基于LNP X递送的mRNA治疗可成为现有ART的有效补充,推动功能性治愈的实现。
“唤醒并清除”方式若能成功临床转化,将减少病毒储存库规模,降低停药后病毒反弹风险,提升患者生活质量。 此外,针对不同病毒亚型、多样性潜伏细胞环境,定制化CRISPR引导RNA组合的策略,也将使治疗更具普适性和灵活性。 总之,基于mRNA和LNP传递技术,尤其是LNP X平台为静息T细胞提供了前所未有的基因递送效率和安全性,开创了HIV潜伏逆转研究的新纪元。 这种创新突破将助力科研人员靶向根源,从病毒潜伏机制出发,研发更精准、更安全的治疗方案,逐步实现攻克HIV持久感染的宏伟目标。 未来整合多学科优势,结合免疫学、生物材料学和基因编辑技术,有望打造可控、可重复使用的mRNA基因治疗载体,广泛应用于病毒感染、自身免疫病和肿瘤免疫治疗领域,推动精准医学新潮流。科学家和临床医生对LNP X及相关mRNA治疗技术继续保持高度关注,期盼更多突破性研究推动其尽快进入临床应用阶段,惠及全球HIV感染者,推动艾滋病治疗迈入新纪元。
。