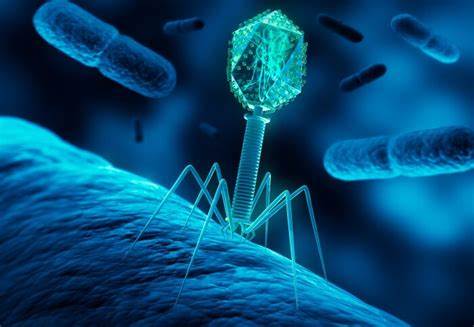
随着耐药细菌威胁日益加剧,全球公共卫生面临前所未有的挑战。科学界正不断探索细菌抗药性的传播机制,以寻找应对方法。近期,英国帝国理工学院的研究团队揭示了一种被称为"微生物劫持"的新现象,这种机制涉及细菌病毒(噬菌体)和特定的遗传元素之间复杂的互动。研究发现,这种"微生物劫持"现象不仅是细菌获得抗药性和致病性基因的重要途径,也为未来抗耐药治疗和诊断开辟了新方向。 细菌和噬菌体之间的关系错综复杂。噬菌体是一类专门感染细菌的病毒,它们的结构形似微型注射器,由包含DNA的头部和用于识别并注入遗传物质的尾部组成。
噬菌体是地球上数量最多的生物之一,且通常具有高度的物种专一性。正因如此,噬菌体被视为潜在的抗菌利器,尤其是在传统抗生素失效时,它们的精准杀菌特性被广泛研究。然而,这些病毒自身也存在被寄生风险。研究发现,一类被称为噬菌体卫星(phage satellites)的遗传元素能够劫持噬菌体的遗传机制和结构零部件,用以传播自身的遗传材料。 近期的研究集中关注了一种称为capsid-forming phage-inducible chromosomal islands(cf-PICIs)的强大噬菌体卫星家族。cf-PICIs广泛存在于200多种细菌中,能够传播抗生素抗性基因和增加细菌毒力的基因,但其传播效率之高及其跨物种能力一直令人费解。
通过深入实验,帝国理工的科学家揭秘了cf-PICIs如何通过"劫持"其他噬菌体的尾部构建出混合型病毒颗粒,即"嵌合噬菌体"(chimeric phage)。 这一嵌合体的头部由cf-PICI自身形成,里面携带cf-PICI的遗传物质,而尾部则来源于被劫持的噬菌体。由于尾部决定感染细菌的特异性,cf-PICIs通过偷取不同噬菌体尾部,实现了广泛感染多种细菌物种的能力。这种"尾巴置换"的策略突破了物种界限,极大增强了cf-PICIs的传播范围和频率。 这样的发现揭示了细菌基因水平转移的一个重要机制,即通过嵌合病毒传播抗药性和致病性基因。细菌基因的多样性和进化进程与这种高效的遗传物质交换密不可分。
更为重要的是,理解cf-PICIs的劫持机制为人类设计新的抗耐药策略提供了潜在路径。研究人员认为,可以通过人工改造和利用cf-PICIs,将其定位于特定的耐药细菌,针对性注入致死基因或者削弱细菌防御系统。此外,这些定制化卫星病毒还有望突破生物膜等细菌抗药防御屏障,提升治疗效果。 这一发现同时推动了相关快速诊断技术的开发。通过检测特定cf-PICI或嵌合噬菌体的存在,可以快速判定细菌的抗药性状态及其传播潜力,帮助临床医生更精准地选择抗生素或调整治疗方案,减少不必要的抗生素滥用,加速诊断和治疗的时效性。 该研究代表了"微生物劫持"这一现象在医学和微生物学领域的重大突破,充分表现出现代基础研究如何促进临床应用的进步。
帝国理工团队已就该技术申请专利,并计划推进其实验室成果向临床转化阶段发展。 除了生物学机制的发现,研究团队还依托人工智能辅助科学工具,进一步加速了本领域的探索。联合谷歌开展的AI"共同科学家"平台在模拟传统科学推理的基础上,独立生成了与实验结果相符合的假设及实验方案,极大缩短了科研周期。AI不仅辅助验证了cf-PICI的传播机制,还展现了在未来微生物遗传研究和抗耐药技术开发中的巨大潜力。 当下,全球抗菌素耐药问题日益严峻,传统药物研发面临巨大的压力与瓶颈。微生物劫持现象的揭示为研发新型抗感染策略提供了创新思路。
科学家们希望借助这种天然的遗传材料交换机制,开发出更加精准、高效、安全的治疗方法,以逆转耐药细菌的扩散趋势。 此外,"微生物劫持"还加深了我们对微生物生态系统以及基因如何在菌群中流动的理解。基因水平转移是细菌快速适应环境和药物压力的重要驱动力,而cf-PICIs等噬菌体卫星作为基因搬运工具的角色尤为关键。未来研究或将进一步发掘更多类似机制,揭示微观世界中生命体之间错综复杂的关系,为公共卫生和生物技术的发展奠定坚实基础。 综上所述,通过深入剖析细菌病毒之间的"微生物劫持"互作,科学界不仅揭示了细菌抗药性传播的秘密,更开启了利用自然机制对抗超级细菌的新时代。随着人工智能和基因工程技术的融合应用,未来的医疗领域有望迎来一场精准、高效的新革命,为全球抗击耐药感染注入强大动力。
。