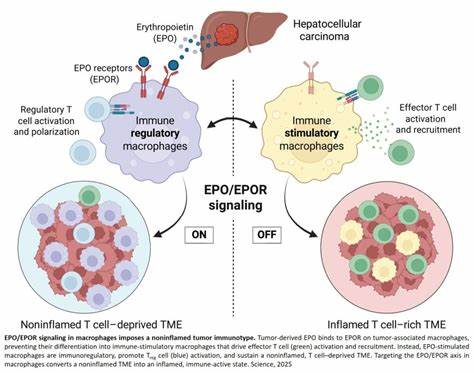
在癌症研究领域,肿瘤如何逃避免疫系统的攻击一直是科学家们关注的焦点。最近,关于肿瘤来源红细胞生成素(EPO)作为一种重要的免疫抑制开关的发现,为理解癌症免疫逃逸机制提供了新的视角。红细胞生成素传统上被认为是一种促红细胞生成的激素,但最新研究揭示,它在肿瘤微环境中也具有调控免疫反应的功能,尤其是在肝细胞癌(HCC)模型中表现突出。肿瘤细胞通过分泌EPO,能够塑造一种非炎症性、免疫抑制的肿瘤微环境,这种环境缺乏有效的免疫细胞浸润,从而限制了免疫系统对肿瘤的攻击力。具体而言,肿瘤释放的EPO与肿瘤相关巨噬细胞(TAMs)表面的红细胞生成素受体(EPOR)结合,触发信号通路改变巨噬细胞的功能状态,使其转变为免疫调节型巨噬细胞。这些被重新编程的巨噬细胞类似于肝脏库弗细胞,不仅促进调节性T细胞(Treg)的激活,还抑制CD8+效应记忆T细胞的数量,最终导致肿瘤微环境中的T细胞稀缺。
免疫细胞的匮乏成为肿瘤抵抗免疫治疗,特别是免疫检查点抑制剂(ICB)疗法的主要障碍。靶向EPO/EPOR信号轴,通过阻断肿瘤分泌的EPO或剔除巨噬细胞上的EPOR,实验中成功实现了肿瘤微环境从非炎症性向炎症性的转换。该转换不仅增强了CD8+效应记忆T细胞的浸润,还显著促进了肿瘤的自发性退缩。这一发现打破了之前对EPO仅作为促红细胞生成激素的传统认知,展示了其作为免疫调节器的双重身份。机制层面上,EPO调控的关键下游因子包括核因子红细胞2相关因子2(NRF2)。NRF2参与诱导巨噬细胞的血红素耗竭和抗氧化剂的生成,这一过程是巨噬细胞由促炎型向免疫调节型转变的核心步骤。
血红素代谢的变化不仅影响细胞的免疫功能,还与抗炎和组织修复密切相关,这为肿瘤创造了逃避免疫监视的生理基础。此外,临床数据进一步支持了这一结论,高EPO表达与多种实体瘤,尤其是肝细胞癌患者的预后不良显著相关。肿瘤中的EPO水平升高往往伴随着免疫抑制细胞如Treg和调节性巨噬细胞的大量积累,说明EPO在肿瘤免疫微环境调节中具有广泛影响。值得注意的是,尽管EPO刺激剂被广泛应用于治疗癌症相关贫血,但其潜在的促进肿瘤免疫逃逸的副作用引发了极大关注。研究提示,在癌症治疗中,需谨慎使用EPO相关药物,避免无意中触发该免疫抑制开关,从而影响患者的生存率。基于以上发现,针对EPO/EPOR轴的创新治疗方法成为癌症免疫治疗新的突破口。
通过基因编辑技术,下调巨噬细胞中的EPOR,或者利用EPOR-Fc嵌合受体作为陷阱结合并中和肿瘤释放的EPO,实验证明能够增强免疫细胞活性,改善肿瘤对免疫疗法的反应率。特别是在非炎症型肿瘤中,这样的策略有望将“冷肿瘤”转化为“热肿瘤”,从而提高免疫检查点抑制剂等免疫治疗的疗效。未来,结合小干扰RNA(siRNA)载体技术精准地调控肿瘤微环境中的EPO/EPOR信号,可能成为临床的重要治疗手段。该技术的应用不仅局限于肝细胞癌,鉴于高EPO表达在多种实体瘤中的共性,针对这一轴的免疫疗法有望广泛惠及其他癌症类型。与此同时,深入探讨EPO在肿瘤微环境中如何影响不同免疫细胞类型,如中性粒细胞、树突状细胞及其他免疫调节因子的作用机制,将进一步完善对肿瘤免疫抑制网络的理解。科学家们也在积极开展临床试验,以验证靶向EPO/EPOR轴的安全性和有效性,为患者带来更多的治疗选择。
综上所述,肿瘤来源的红细胞生成素不仅仅是调节红血球生成的激素,更是癌症免疫中的关键免疫抑制开关。它通过改造肿瘤相关巨噬细胞的免疫表型,维持一个非炎症性、T细胞贫乏的肿瘤微环境,助力肿瘤逃避免疫监视。靶向这一信号通路的创新免疫策略,不仅有望改善现有免疫检查点抑制疗法的效果,也为抗击肿瘤免疫逃逸提供了全新的方向。随着相关研究的深入及技术不断进步,未来针对EPO/EPOR轴的治疗方案有望成为癌症免疫治疗领域的里程碑,推动实现更精准、更高效的肿瘤免疫疗法。