近年的神经科学与代谢学交叉研究正在重塑我们对"应激如何影响全身代谢"的认知。传统上,心理或生理应激被认为主要通过下丘脑 - 垂体 - 肾上腺轴(HPA轴)以及交感神经激活来调节血糖和能量动员。然而,2025年发表在Nature上的一项突破性研究提出并验证了一个全新的中枢‑外周联动通路:杏仁核(medial amygdala,MeA)直接通过多突触神经回路影响肝脏,快速调控葡萄糖合成与释放,从而在急性应激中主导高血糖反应,同时其功能在反复应激后发生改变,可能推动糖代谢紊乱。该发现对理解应激相关代谢疾病、开发新型治疗策略以及公共健康干预均具有深远影响。研究团队采用多模态手段,包括神经活性成像、化学遗传学与光遗传学操控、空间转录组学、病毒追踪与同位素代谢示踪,为杏仁核 - 肝脏轴提供了系统性证据,值得逐步解读与反思。 研究亮点与核心结论 研究从行为‑代谢关联入手,证实短时的物理和社会应激(如束缚或同类气味刺激)会在数分钟内显著升高小鼠血糖并抑制进食。
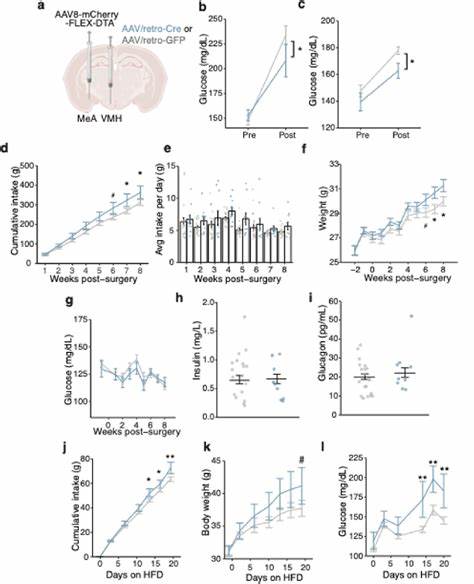
利用FOS免疫标记与体内光纤钙成像,作者发现应激触发MeA特定神经元亚群的快速激活,且这种激活先于血糖上升,提示MeA处于反应环路的上游。更进一步的投射追踪显示,MeA中投向腹内侧下丘脑(VMH)的神经元在应激中被选择性动员。用化学遗传学与光遗传学特异性激活或抑制MeA→VMH通路,研究者能够诱导或抑制应激相关的高血糖反应,而这一效应并不依赖于肾上腺皮质激素(皮质醇/皮质酮)或胰岛素等经典内分泌因子。转录组学分析揭示MeA→VMH神经元由混合的兴奋性与抑制性细胞构成,并富集多种与代谢相关的人类基因变异位点,提示其在人类代谢稳态中的潜在作用。 更令人信服的是,回溯性病毒与多突触示踪配合外周肝脏注入的逆行病毒,映射出MeA到肝脏的多步神经通路。激活该通路能够增强肝脏葡萄糖生成相关基因表达(如G6pc)并在[2,3‑13C]丙酮酸示踪实验中显著提高关键中间产物的13C标记量,直接证明了中枢活动促进肝脏去新生葡萄糖(gluconeogenesis)。
与此同时,区域性交感神经中枢和节段(如蓝斑与腹腔神经节)在通路激活后表现出活性增强,提示中枢对外周交感系统的调节是其实现肝脏代谢重编程的关键节点。 慢性或反复应激对该回路的影响也在研究中被揭示。多次短间隔的应激暴露导致MeA及其投射核对后续刺激的不应答,表现为神经活性逐渐钝化并伴随应激诱发的高血糖反应减弱。通过选择性耗除MeA→VMH神经元,研究者观察到在高脂饮食条件下小鼠出现体重增加、空腹血糖与糖耐量受损,以及肝脏β/α肾上腺能受体表达的改变,进而提示该通路长期失调可能使机体更易走向肥胖与2型糖尿病样表型。 机制解读:为何是杏仁核与肝脏连接 杏仁核以其在情绪与社交行为的处理、威胁识别与防御反应中核心作用著称。MeA接收来自嗅觉、社交线索以及多个皮层与下丘脑区域的输入,能够将复杂的情绪信息转化为相应的生理准备状态。
在本研究中,MeA的激活并未通过传统的HPA轴或胰腺‑肾上腺激素直接介导血糖上升,而是通过一个较为直接的神经通路影响肝脏代谢。这样一种"快速通路"在生物学上具有清晰的合理性:应对立即的外界威胁需要迅速动员能量,单纯依靠激素级联往往速度不足,而神经系统可以在几秒到几分钟内完成信息传递与外周器官的协同调节。 数据支持交感神经介导的可能性。MeA激活后,蓝斑(locus coeruleus)与腹腔神经节(coeliac ganglia)等交感中枢和周边节段出现FOS阳性与酪氨酸羟化酶(TH)表达增加,且肝脏中与腺苷酸环化酶信号相关的受体亚型表达改变(α2、β2受体)与葡萄糖代谢变化相关,均提示通过改变交感对肝细胞的神经调制来调整葡萄糖输出。葡萄糖代谢组学与同位素示踪进一步明确了葡萄糖前体在肝脏中被更大比例地引入糖异生途径,形成了从神经活动到分子代谢的闭环证据链。 研究意义与临床前景 这项工作以系统的神经电生理学、分子生物学与代谢组学相结合的方式,证明了大脑情绪中枢可以通过具体的神经回路直接影响外周代谢器官,开辟了理解应激与代谢疾病关系的新视角。
其临床和公共卫生意义可以从多个维度解读。 在诊断与风险预测方面,若相关回路在人类中也具可探测的表型或生物标志物(例如功能影像学信号模式、周边交感活动的特征性变化或肝脏受体表达谱),则可能用于识别因反复心理应激而更易发生代谢紊乱的人群,从而实现早期干预。 在治疗策略层面,本研究提示通过调控杏仁核 - 下丘脑 - 交感 - 肝脏轴的节点,可能产生新的治疗方向。脉冲式或周期性调控中枢神经元活动的神经调控技术(例如经颅磁刺激、靶向神经调控或未来的基因/细胞疗法)或针对外周神经节的靶向阻断,都可能在不依赖全身性激素调节的条件下,快速调整应激相关的血糖波动,从而既能应对急性需求也避免长期代谢负担。 此外,对传统代谢药物的理解也将被扩展。例如,抗交感药物、特异性肝脏受体拮抗剂或针对葡萄糖异生关键酶(如G6Pase、PCK1)的小分子抑制剂,结合对心理压力管理的干预,或能为应激相关代谢紊乱提供更综合的治疗方案。
需要谨慎的地方与未来研究方向 尽管研究设计严密且证据链完整,但将小鼠研究直接外推到人类仍需谨慎。人类大脑与情绪反应的复杂性更高,应激类型与持续时间的差异也更为多样。同时,本研究主要使用雄性小鼠或以雄性为主样本,性别差异在应激与代谢响应中可能发挥重要作用,需要进一步验证雌性样本与不同年龄段的可重复性。 关于长期影响的机制亦需进一步揭示。反复应激导致MeA→VMH轴"钝化"的分子基础尚不明确,是突触可塑性、神经元丧失还是神经调质改变所致?其恢复性的可塑性如何?另外,不同类型的应激(心理社交、慢性轻度压力、创伤性应激)是否对该轴产生不同的重塑模式也值得探讨。 转化研究应着重回答两个问题:首先,是否存在可测的、对应人类的功能性或分子性生物标志物,能反映该轴的活动或病理改变?其次,针对该通路的干预是否在人体中既安全又有效?临床前的毒性、长期效应和器官特异性问题需谨慎评估。
生活方式与公共健康的启示 研究强调了心理压力与代谢健康之间的直接神经联系,提示管理长期或重复的应激暴露不仅有心理益处,也可能减少代谢性疾病风险。常见的压力管理方法(规律运动、充足睡眠、正念冥想、社会支持网络)在动物与临床研究中均能缓解交感激活与炎症反应。结合本研究的发现,有针对性地在高风险人群中推广压力缓解干预,可能成为预防代谢疾病的有效策略之一。 结语 杏仁核 - 肝脏轴的发现为理解应激与能量代谢之间的交互提供了全新框架。它强调了情绪性神经回路在外周代谢调控中的主动角色,提示在面对急性威胁时,大脑可以通过快速的神经通路直接重编程肝脏代谢以满足能量需求。更为重要的是,反复应激导致该通路功能重塑,可能成为连接心理压力与代谢疾病的关键桥梁。
未来通过多学科合作,把神经科学、代谢学、临床医学与公共卫生相结合,将有望将这些基础发现转化为预防和治疗应激相关代谢疾病的新工具和新策略。 。