近年来,mRNA技术的突破性进展极大改变了医疗和生物制药领域的景观,尤其是在疫苗研发与基因治疗中展现出巨大潜力。然而,mRNA分子本身易受降解及难以准确传递到目标细胞,使其临床应用面临极大挑战。脂质纳米颗粒(LNP)作为一种有效的mRNA载体,因其能够有效包裹和保护mRNA而获得广泛关注,但如何确保这些携带mRNA的纳米颗粒精准地到达特定细胞,避免非特异性吸收,仍是亟待解决的问题。为了应对这一挑战,科学家们开发了一种创新性的抗体捕获系统,该系统通过一种称为TP1107的纳米抗体(纳米体)针对抗体Fc结构的高亲和力,将靶向抗体以最佳定向方式稳固结合在LNP表面,从而显著提升mRNA的靶向传递效率和表达水平。这种抗体捕获系统的核心优势在于其无需对抗体进行化学修饰,保留了抗体完整的抗原识别能力,同时极大简化了纳米颗粒的功能化流程。传统的抗体偶联方法多依赖于随机化学反应,导致抗体在粒子表面呈现随机取向,阻碍了抗体结合受体能力,降低了靶向效率。
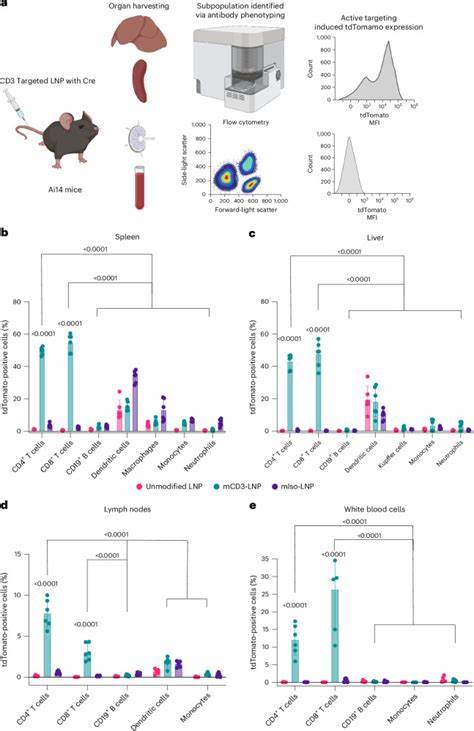
同时,复杂的纯化步骤也增加了制备成本和时间。相比之下,TP1107纳米抗体经过周密的结构解析,通过负染电子显微镜确定其与抗体Fc段的结合位点,并采用遗传密码扩展技术将含有叠氮苯丙氨酸的纳米抗体定点偶联于长链PEG脂质上,实现最佳方向的抗体捕获。这不仅保证了抗体的准确定位,也提高了其与细胞受体的结合效率。将这种定向偶联的纳米抗体整合至脂质纳米颗粒表面后,研究人员发现,经过抗体修饰的LNP在目标细胞如T细胞上的mRNA表达水平,较无靶向修饰的LNP提高一千倍以上,同时较传统随机偶联的抗体修饰LNP提升约八倍。这些定向结合的LNP通过体外细胞模型、人体外周血单核细胞(PBMC)以及小鼠体内实验,进一步验证了其显著的靶向能力和特异性。具体来说,使用针对人类或小鼠特定T细胞表面抗原(如CD3、CD4、CD5、CD7)的抗体修饰的LNP,不仅实现了对T细胞的高效靶向,还大大减少了对其他免疫细胞的非特异性递送,体现出优异的靶向选择性。
此外,在小鼠体内注射携带Cre重组酶mRNA的CD3抗体修饰LNP后,靶向T细胞的克隆报告基因被强烈激活,而旁系细胞几乎无表达,直接证明了该系统的体内高度专一性和有效性。抗体捕获系统的另一个显著优势是其为快速筛选和评估多种潜在靶点抗体提供了极大便利。研究团队利用该技术,能够迅速测试包括CD3、CD4、CD5、CD7及CD22等多个免疫细胞表面受体的靶向性能,实现针对不同细胞类型的高效递送。这种模块化策略不仅加速了优化靶向载体的进程,也为个性化精准治疗奠定基础。事实上,单从受体表达水平来预测递送效率往往存在偏差。研究显示,尽管某些受体在靶细胞表面高表达,但其介导的纳米颗粒内吞能力有限,从而限制了mRNA递送的效率。
与之相对,CD3受体不仅表达稳定,同时高度参与T细胞的信号传导和活化过程,使其成为理想的递送靶点。这一事实进一步凸显了筛选合适靶向抗体及其定向连接策略的重要性。对LNP的PEG成分也进行了细致对比研究,发现采用具有较长脂链的DSPE-PEG2000,相较于短脂链的DMG-PEG2000,能更稳定地锚定纳米抗体于LNP表面,显著降低非特异性细胞结合,提高靶向效率,并最终促进mRNA表达。该发现对未来LNP抗体修饰技术的配方优化具有直接指导意义。在安全性方面,携带抗体捕获纳米抗体的LNP在体内显示出良好的耐受性。尽管抗体可能诱导轻微的免疫激活反应,这在某些特定抗体如抗CD3抗体中属预期内现象,但整体无显著的组织毒性或体重改变,支持其临床开发的可行性。
未来,随着mRNA疗法逐步拓展至非疫苗领域,如基因编辑、癌症免疫疗法以及罕见病治疗等,确保mRNA递送的精准性和有效性尤为关键。抗体捕获系统提供了一种高效且灵活的平台,不仅降低了功能化LNP的复杂性,也提高了靶向活性和生产适应性。此系统可广泛应用于各种mRNA载体,实现针对不同细胞类型的定制化治疗方案。总的来说,抗体捕获系统代表了mRNA脂质纳米颗粒体内递送技术的重要进展。通过结构生物学指导设计的定向纳米抗体偶联,成功解决了传统抗体偶联中抗体随机定向导致的低效及复杂制备问题。系统在体外、ex vivo以及体内都展现出卓越的特异性和递送效率,充分验证了其在精准核酸药物治疗中的潜能。
随着技术不断成熟和应用场景的拓展,这一创新平台有望加速mRNA疗法从疫苗向广泛疾病治疗的转变,推动精准医疗迈入新纪元。 。