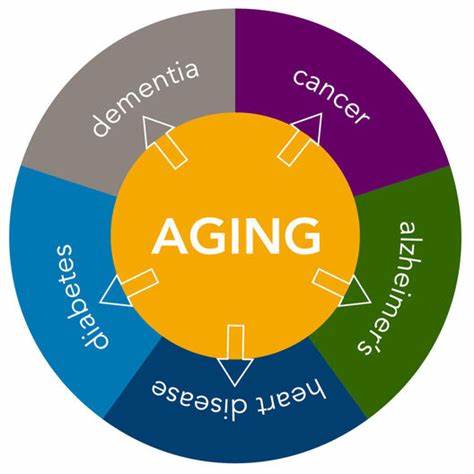
随着人类寿命的延长,衰老相关疾病成为当前医学研究的重要领域。无论是预防损伤还是在损伤出现后进行治疗,现阶段的医学手段在这些疾病面前仍显得力不从心。虽然不少药物获得监管机构批准,但在实际疗效上往往只能缓解病情的恶化速度,难以改变疾病的终极走向。本文将结合几种关键的衰老相关疾病,剖析我们在治疗方面的局限与挑战。地理萎缩(GA)是一种导致视网膜中央视力逐渐丧失的疾病,主要由于视网膜色素上皮及感光细胞的退化所致。近年来,市场上出现了Syfovre(pegcetacoplan)和Izervay(ACP)两款获批药物,但它们无法阻止疾病的进展,只能将病变的增长速度减缓约19%。
值得注意的是,研究者已逐渐放弃以视力检测(比如最佳矫正视力BCVA分数)作为主要临床终点,转而采用“病灶增长”这一指标来衡量疗效。即使在试验数据上显示统计学意义,患者及其家属往往难以感知明显的视力改善,令人难以满足。特发性肺纤维化(IPF)作为一种肺部病变,病因尚不明晰,肺组织逐渐纤维化导致呼吸功能受损。主要获批药物包括2014年批准的尼达尼布(nintedanib)和吡非尼酮(pirfenidone)。虽然两种药物均未能改善病人的肺功能容量(FVC)或整体预后,但它们可以在一定程度上减缓肺功能的下降速度。令人遗憾的是,吡非尼酮的关键三期试验中,部分数据未达预期疗效标准,但该药依然获得了批准,显示出药企在审批门槛与疗效标准之间的复杂博弈。
针对非酒精性炎症性脂肪肝病(MASH),2024年批准的瑞麦膦酮(resmetirom)成为首个获批治疗药物。其疗效主要通过评估MASH病情缓解和肝纤维化改善这两个指标衡量。在高剂量治疗组中,约三成患者实现了病情明显改善,相比安慰剂组提升显著。不过,目前大多数试验仍聚焦于疾病的早中期(F1-F3),而晚期纤维化(F4阶段)患者的治疗方案几乎没有获批用药,显示临床需求远未被满足。阿尔茨海默病(AD)则因其复杂多变的病理机制成为老年病研究的最大难题。尽管FDA在2021年曾批准抗β淀粉样蛋白药物Aducanumab,但因疗效存疑而被撤市。
2023年获批的Lecanemab(Leqembi)机制与Aducanumab类似,欧洲药监机构则未予批准。虽然Lecanemab在临床认知评分(CDR)上显示出了减缓认知衰退的统计学意义,但依旧无法阻止患者整体走向认知恶化,且药物副作用显著,包括脑部水肿和微小出血风险增加。另一款Donanemab则根据患者脑内tau蛋白水平分组试验,低tau组患者反应稍好,但同样伴随严重的安全性问题。整体来看,衰老相关疾病的治疗药物大多呈现“减缓病情进展而非治愈”的趋势,捉襟见肘的疗效反映了科学认知与技术手段的局限。多数获批药物尽管在统计学依据上达标,却难以转化为患者可感知的临床改善,甚至出现显著副作用,进一步限制了其应用范围和患者接受度。这种现状的背后,既有疾病本身复杂多因的病理基础,也有临床试验设计与终点选择上的不足。
许多研究早期依赖视觉能力、肺功能或认知评分,难以全面反映疾病微妙但关键的进展变化,导致药物疗效评估失真。此外,晚期疾病阶段患者往往被排除在试验之外,限制了新药对重症患者的潜在价值发挥。未来,衰老相关疾病治疗的突破需依托于基础科学对病因机理的深入揭示。不仅仅是症状管理,真正治愈或逆转损伤的方法才能根本改变疾病轨迹。与此同时,临床试验设计也应更多考虑患者生活质量和长期疗效,发展更精准和多元的生物标志物,提升疗效评估的敏感性和可靠性。技术层面,新一代生物制剂、基因疗法及细胞治疗的发展为攻克衰老相关疾病带来了前所未有的希望。
来自业界的创新力量不断涌现,挑战传统治疗模式,推动药物研发进入全新的阶段。总之,当前面对衰老相关疾病,我们处于一个疗效有限、挑战重重的阶段。尽管如此,人类的探索脚步从未停歇,未来凭借科技进步与跨学科合作,期待在这一领域迎来更加有效的治疗方案,提升老年人群的生活质量,延缓衰老的脚步。