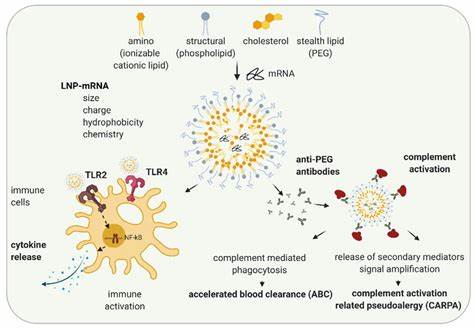
肠道炎症,尤其是炎症性肠病(IBD),已成为全球范围内影响公众健康的重要隐患。目前常规治疗手段存在疗效有限、剂量依赖性副作用显著等缺陷,促使科学家们寻求创新的靶向治疗策略。近年来,核酸类药物,特别是锁核酸(LNA)技术的出现为肠道炎症治疗打开了新局面。通过脂质纳米颗粒(LNP)高效精准的递送,锁核酸在降低用药剂量、提升疗效及减少副作用方面表现出巨大潜力,成为前沿的研究热点。锁核酸是一种第三代反义寡核苷酸,结构独特,具有极高的结合亲和力和序列特异性,这使其能够精准干扰靶标基因表达,达到调控病理过程的目的。与以往的核酸药物相比,锁核酸能够稳定存在于体内,并较强地与靶mRNA结合。
然而,锁核酸本身的高度亲和性同时带来了稳定性过强引起的离靶效应风险,以及结构刚性对细胞摄取的阻碍,使得临床应用受限。针对这些挑战,科学家们借助脂质纳米颗粒这一先进的非病毒载体,将锁核酸包封并递送至炎症部位,通过物理保护和靶向传递,有效提升了其生物利用度和靶向性。脂质纳米颗粒由离子化脂质、胆固醇、辅助脂质和聚乙二醇脂质等组成,能在生理条件下中性带电,提升血液循环的稳定性,避免免疫系统的清除。当纳米颗粒进入细胞体内后,随着囊泡酸化,脂质转变为正电荷,有效破坏内体膜,帮助载体释放所携带的核酸药物,实现细胞质内的高效利用。在临床和研究领域,脂质纳米颗粒已成功用于mRNA疫苗的递送,有力验证了其作为递送平台的安全性和高效性。结合锁核酸,脂质纳米颗粒能够精准调控肠道炎症相关基因表达,取得惊人的治疗效果。
最新研究中,科学家筛选了多种创新型离子化脂质以制备不同的脂质纳米颗粒配方,通过无细胞和细胞水平的评估,锁定了在粒径、包封率、pKa值和生物相容性方面表现最佳的候选配方。该配方不仅保证了锁核酸在体内的稳定释放,更显著降低了治疗剂量,充分体现了脂质纳米颗粒递送系统对锁核酸疗效的提升作用。在炎症性肠病模型小鼠中,脂质纳米颗粒递送的针对肿瘤坏死因子α(TNFα)mRNA的锁核酸成功减少了炎症因子的表达,减轻了组织损伤,促进了肠道组织的修复。相比自由锁核酸药物,脂质纳米颗粒制剂实现了30倍剂量的减少且无明显安全隐患,显示出优异的治疗指数。更为重要的是,脂质纳米颗粒展示了炎症组织的天然靶向性,能够优先在肠道炎症部位积累,与肠壁的内皮细胞、巨噬细胞和中性粒细胞功能性结合,精准作用于病变细胞,极大限度减小系统性副作用。此外,研究还表明锁核酸载脂质纳米颗粒在肠道内的细胞摄取效果显著,促进了分子干预的有效性。
安全性评价结果显示,肝脏酶学指标、免疫细胞计数等多个参数均未出现显著波动,表明该递送体系具备良好的耐受性和生物安全性。该递送平台的发展为核酸药物的临床转化奠定了基础,也为炎症相关疾病的精准治疗带来了全新可能。展望未来,结合脂质纳米颗粒的精准工程改造,如表面配体修饰,实现针对性更强的细胞亚群递送,将进一步优化治疗效果。结合人体临床样本和更复杂的疾病模型,深入解析动力学分布、免疫调控和长期疗效,将有助于推动这一创新疗法走向临床应用。此外,随着核酸药物化学修饰的不断创新及纳米技术的进步,锁核酸与脂质纳米颗粒相结合有望在自体免疫、代谢及癌症等其他疾病领域展开更广阔的应用。总结来看,锁核酸通过脂质纳米颗粒的递送策略,实现了对肠道炎症的精准靶向和高效调控,极大地提升了治疗的安全性和有效性。
该技术不仅突破了核酸药物递送的瓶颈,更为炎症性肠病患者带来新的治疗希望。伴随着进一步的研究与临床验证,未来有望成为改变IBD治疗范式的革新力量。 。