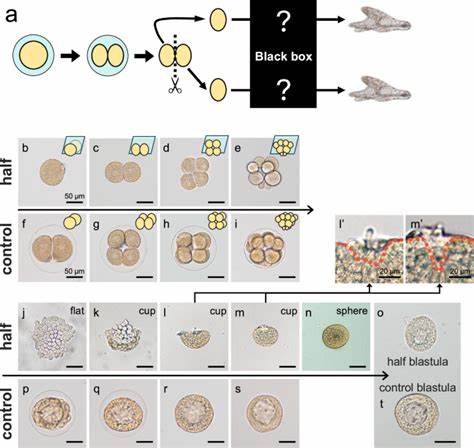
海胆作为模式生物在胚胎发育研究领域长期占据重要地位,尤其是在探究胚胎自我调节与再生的机制方面发挥了不可替代的作用。1891年,Hans Driesch的开创性实验首次证明了动物早期胚胎即使被人为分割,依然可以独立发育成完整个体,凸显了胚胎高度的调节性发育能力。海胆同卵双胞胎的发展过程,不仅为调节性发育研究提供了理想模型,更揭示了胚胎内在的自组织和形态恢复机制。本文聚焦于日本海胆物种Hemicentrotus pulcherrimus,从细胞形态学变化到分子信号机制,深入解密同卵双胞胎胚胎如何在胚裂早期拆分后仍能实现完整发育的奥秘。实验中将受精后2细胞期胚胎进行切割,获得两半胚胎单元。与正常胚胎相比,这些半胚胎经历了一段特殊的形态过程,包括由扁平形态向杯状逐渐过渡,最终封闭形成球状的囊胚结构。
尽管半胚胎发育速度较完整胚胎稍慢,但最终能够形成类似完整胚胎的小型囊胚,并继续完成后续的胚层内陷和手臂骨骼形成。细胞数目的统计分析表明,形态转变并非依赖于细胞数量的增加,而是细胞形状的显著改变所致。具体而言,细胞沿着顶底轴极度拉长,形成锥形结构,随着杯状开口的边缘不断闭合,最终形成紧密的球形细胞层。这一变化背后的分子动力学机制尤为引人关注。细胞骨架中的肌动蛋白-肌球蛋白系统在驱动细胞形态转变中发挥核心作用。通过Lifeact-mCherry标记和共注射带有核定位指示的染色体荧光蛋白,观察到半胚胎细胞基底侧出现强烈的肌动蛋白聚合。
这种基底侧肌动蛋白积累与正常胚胎细胞表面肌动蛋白富集位置迥异,显示出特有的细胞内动力学调整。抑制肌动蛋白聚合药物如环孢酶D及肌球蛋白活性抑制剂(-)-blebbistatin的实验,进一步验证了肌动蛋白-肌球蛋白网络对细胞伸长及形态转换的必要性。细胞间的黏附结构同样不可或缺。半胚胎在扁平向球形转变的时期伴随着边界细胞之间隔板连接(septate junction)的形成。相关基因tetraspanin及ZO-1在此阶段广泛表达,其功能缺失实验则导致形态转变严重障碍,细胞无法形成规整的单层排列,导致半胚胎停留在不规则的"凸凹"形态。此结果显示,细胞的机械结合力是保证半胚胎结构完成闭合和形成球形的基础。
调节性发育的另一核心问题是胚体轴的重建。正常海胆胚胎通过Wnt/β-连环蛋白信号维持前后(A-P)轴的稳定定位,而D-V轴由Nodal、Lefty和BMP信号调控。半胚胎在形成球形阶段经历前后轴的临时紊乱,标志性前端基因foxQ2与后端基因foxA表达域暂时相邻,轴信息暂时混乱。不过,随着发育进程的推进,Wnt/β-连环蛋白信号在原有后端邻近区域重新激活,驱动前端表达区域向远离后端的对侧位移,确保A-P轴的正确重建。这一轴再组织过程的细胞标记追踪显示前端细胞命运重新确认的空间迁移,而后端细胞命运较为稳定,没有大规模迁移。此外,非经典Wnt/JNK信号也在这一转变中扮演辅助角色,部分调控前端区的最终确定。
D-V轴的形成亦经历了类似的动态调节。Nodal信号在半胚胎杯状和球状阶段呈现异常的全胚表达,伴随着Nodal下游转录因子pSmad2/3的广泛核定位,暗示信号被广泛激活。随后,随着前后轴的重建,Nodal表达逐渐局限于未来腹侧区域,标志D-V轴逐步恢复。BMP信号下游pSmad1/5/8的活化时间与完整胚胎同步,表现出正常的侧化趋势。FoxQ2在抑制Nodal自促环路的机制中起关键作用,其位点的重新定位间接促进了D-V轴的稳定建立。上述发现共同表明,半胚胎胚体轴的重建不是依赖新的细胞分化,更多是通过利用已有的发育信号机制,结合细胞形态的重塑完成的。
调节性发育的实现不仅展现了胚胎早期的自我修复和再组织能力,也从分子到力学层面揭示了细胞如何在失去部分胚体结构时重新分配空间和功能,以满足整体发育需求。细胞自身维持的顶底极性保证其对基质与邻细胞的正确连接,保证细胞单层组织的形成和完整性。此外,肌动蛋白-肌球蛋白介导的细胞形变力学,为形态变化提供动力,而septate junction增强细胞间黏附力,协同支撑形态转变。Wnt/β-连环蛋白信号的阶段性重新激活表现出胚胎内在的信号应答灵活性,能根据外部结构状况调整轴向模式的表达,实现胚轴信息的再确认和稳定。类似于两栖类动物蛙类在胚裂截断后发生的形态轴移位现象,海胆的自调节现象体现出发育调控的高度保守性和机制通用性。探究不同海胆种类及其他棘皮动物胚胎的类似机制,将有助于进一步挖掘生物体发育过程中的演化多样性与共性。
研究揭示的分子与力学机制在再生生物学与组织工程领域同样具有重要意义,为人工器官构建和组织再生策略提供理论支撑。通过控制细胞形态变化和重新激活关键发育信号,有望促进受损组织的修复与再生。总的来说,海胆同卵双胞胎胚胎的调节性发育以自身细胞形态变化、细胞间黏附重构及信号轴的重建为关键步骤,构筑起胚胎结构和功能完整性的基础。其背后的分子机制提示胚胎发育具备内在的高度弹性和稳定性,能够自主应对早期结构的剧烈扰动。随着现代生物技术的不断发展,对这一自组织现象的深入剖析将持续,进一步推动我们对动物胚胎发育调节性和分子网络的理解,拓展再生医学和发育生物学的应用边界。 。