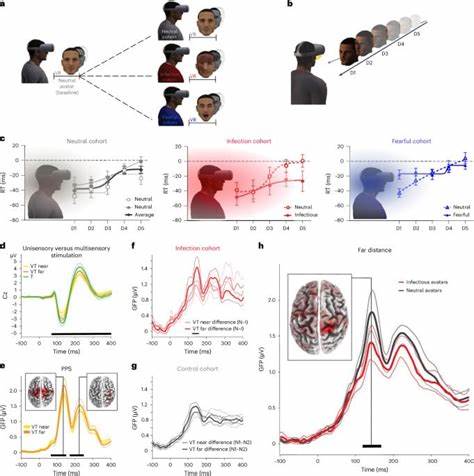
朊病毒,也被称为蛋白质传染粒子,是一种独特的传染因子,与传统的病毒、细菌和真菌截然不同。它们并不含有核酸,只有异常折叠的蛋白质分子,能够诱导正常蛋白质发生错误折叠,进而引起一系列神经退行性疾病。朊病毒因其非同寻常的感染机制及极高的致死率,一直是生命科学和医学领域备受关注的难题。 朊病毒最初的发现与20世纪下半叶关于绵羊瘙痒病(Scrapie)的研究紧密相关。科学家们发现,这病的致病因子难以被常规的灭活手段清除,同时它没有遗传物质,让人们对传统病原体的认识产生怀疑。美国科学家斯坦利·普鲁西纳在1982年正式提出朊病毒的概念,强调其作为"蛋白质性传染粒子"的特性,这一革命性假说最终使他获得了1997年的诺贝尔奖。
在人体和多数哺乳动物体内,自然存在一种称为主要朊病毒蛋白(PrP)的蛋白质。正常的PrP蛋白折叠成富含α螺旋结构的形式,稳定且无害。然而,当这种蛋白质错误折叠成富含β折叠结构的致病形态,称为PrPSc时,它就具有传染性和致病性。PrPSc不仅能够逃避蛋白酶的降解,还会将周围的正常PrP蛋白诱导成不正常构象,形成大量淀粉样蛋白纤维,沉积在中枢神经系统,引发神经细胞死亡和海绵状脑组织改变。 朊病毒疾病统称为传染性海绵状脑病(TSE),涵盖了包括疯牛病(牛海绵状脑病)、克雅氏病、羊瘙痒病、慢性消瘦病等多种畜牧动物及人类疾病。人类的克雅氏病又分为散发型、遗传型和获得型,其中获得型较为罕见,往往与食用受感染的动物产品有关联。
朊病毒相关疾病具有较长的潜伏期,可能长达数年甚至数十年,但一旦发病,病情将迅速恶化并不可逆转,最终绝大多数患者因大脑严重损伤而死亡。 朊病毒的传播方式主要是通过摄入含有PrPSc的物质。在动物中,感染可通过食物链进行扩散,病变动物的遗骸、尿液、唾液中均可能含有可传染的朊病毒粒子。研究显示,朊病毒甚至能通过土壤中的矿物质与有机质结合长时间存活,使环境成为潜在的传染源。惊人的是,近年研究证明植物可能会吸收和保留环境中的朊病毒,通过被食用而完成循环,显示其在生态传播中的复杂性。 从分子机制角度来看,朊病毒折叠的传递及复制并非基因信息的复制,而是蛋白质构象的模板导向改变。
朊病毒通过其聚集体或纤维的末端附着正常PrP,使其结构发生转变,随后延伸纤维,并通过断裂反应产生更多的增殖点,从而实现指数级的扩散。因其异常的β折叠结构,朊病毒对高温、放射线和常规化学消毒剂表现出极强的抵抗力,极大地增加了医疗器械及畜牧产品传播的风险。 尽管研究人员已深入揭示朊病毒的生物学特性,但目前尚无有效的治疗方法。药物开发遭遇重重难关,人类临床试验多以失败告终,仅能对患者症状进行缓解和改善生活质量的支持治疗。研究亦发现部分动物体内具有能够降解PrPSc的细胞机制,如自噬和蛋白酶体途径,在延缓病情方面发挥一定作用,为未来研制针对性药物提供了潜在方向。 朊病毒的发现也促使科学界重新审视诸多神经退行性疾病的发病机制。
近年来,阿尔茨海默病、帕金森病、肌萎缩侧索硬化症等疾病中发现了与朊病毒类似的蛋白质错误折叠及自我传播现象,提示它们可能具有"朊样"性质。尤其是阿尔茨海默病中β-淀粉样蛋白和Tau蛋白的异常聚集,和朊病毒的传染机制有诸多相似之处,这为理解病理进展提供了新的思路。 此外,朊病毒研究领域还发现了一些具有朊样性质的蛋白质,如α-突触核蛋白,其异常聚集与多系统萎缩等疾病相关,甚至表现出可传染性。这一发现拓宽了朊病毒的定义和研究范围,同时引发了关于蛋白病理自我复制与传播的更广泛科学讨论。 环境防控方面,因为朊病毒极强的耐久性与抗降解性,各国卫生组织不断完善对医疗用品、食品安全和动物产品的管理措施。国际卫生组织推荐采用高浓度氢氧化钠或次氯酸钠浸泡结合高温高压灭菌等方法,尽可能消灭残留的朊病毒污染。
此外,对动物饲养环境的监测和管理,以及农业生产的严格卫生制度也成为控制朊病毒传播的关键环节。 在历史上,人类对朊病毒病症的认知经历了漫长而曲折的过程。从早期对羊瘙痒病的观察,到对"库鲁病"这一移传病的深入研究,再到朊病毒作为独特传染因子的正式定义,每一个进展都凝聚了无数科学家的努力。朊病毒这个革命性的发现不仅重塑了医学病毒学的基本概念,也促使对蛋白质结构与功能关系的认知迈上新台阶。 未来的朊病毒研究重点将聚焦于深入解析其三维折叠结构,提高早期诊断技术的敏感性,开发能够阻断蛋白质错误折叠或促进异常蛋白清除的创新疗法。同时,对朊病毒在人类其他非典型神经疾病中的角色展开探索,或许能够揭示更多疾病的本质及治疗的新方向。
总结而言,朊病毒作为一种非传统的传染因子,虽小但极其致命,开启了对蛋白质构象病的全新认识。它跨越了传染病学、神经科学和结构生物学,带来了挑战也孕育着希望。只有通过跨学科的持续努力,未来才能有效防控朊病毒相关疾病,保障人类和动物的健康安全。 。