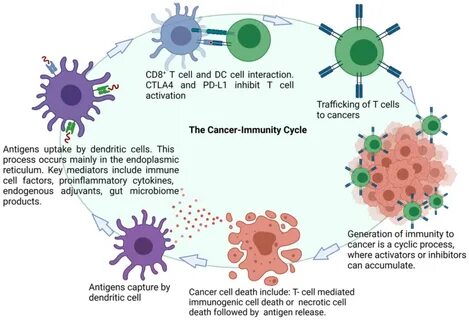
胰腺导管腺癌(PDAC)作为一种恶性程度极高的消化系统肿瘤,长期以来因其突变负荷低、免疫环境寒冷及对传统免疫治疗反应不佳而成为肿瘤免疫治疗领域的重大挑战。近年来,基于RNA的新生抗原疫苗的出现,为胰腺癌治疗带来了前所未有的希望。通过靶向特定的肿瘤特异性新生抗原,这类疫苗不仅能够激活主人的免疫系统,而且能够诱导持久且功能强大的CD8+细胞毒性T淋巴细胞(CTL)反应,从而有效延缓肿瘤复发,提高患者的生命质量。最新发表于权威期刊《Nature》2025年2月的一项研究,以胰腺癌患者为对象,展开了为期逾三年的临床随访,系统呈现了RNA新生抗原疫苗——autogene cevumeran,对CD8+ T细胞的长期激活及其临床疗效的深度剖析。患者在手术切除胰腺肿瘤后,接受了依次给药的PD-L1抑制剂阿特珠单抗、个体化RNA新生抗原疫苗和强效化疗方案mFOLFIRINOX联合治疗,研究发现疫苗应答者展现出显著延长的无复发生存期(RFS),其CD8+ T细胞克隆不仅数量众多,同时具备高功能活性和多年的寿命预估,部分克隆的潜在存活时间甚至超越患者自身寿命。通过先进的T细胞受体(TCR)高通量测序技术——CloneTrack,研究团队追踪了疫苗诱导的T细胞克隆,从而证实这些克隆并非术前宿主已有的免疫细胞扩增,而是经过疫苗直接激活的全新克隆。
令人关注的是,这些新生克隆在经过多轮疫苗刺激以及随后高强度化疗后依然稳固存在,表明疫苗具备诱导耐受性低且持久免疫应答的极佳潜力。免疫功能检测显示,疫苗诱导的CD8+ T细胞具备多功能特征,能够在长期内分泌关键细胞因子如干扰素γ和肿瘤坏死因子α,维持有效的细胞毒性能力。这种多效应功能的维持为其持续监控和潜在清除微小肿瘤灶提供了免疫学基础。同时利用单细胞RNA测序结合TCR测序的PhenoTrack算法,团队揭示了疫苗诱导的CD8+ T细胞在体内所处的表型演变。初期T细胞以高度增殖的状态出现,随后进入收缩期表现出效应细胞状态,最终维持在类似组织驻留记忆(TRM)细胞的状态,表现出优异的记忆及组织驻留特性,并可循环至外周血。这种记忆效应细胞状态极有可能是其多年代谢活跃且具备迅速反应潜力的根基,对于抵御肿瘤复发极为关键。
研究还发现复发患者中疫苗诱导的T细胞免疫反应较弱或出现较晚,这提示疫苗的免疫强度与临床疗效的正相关性。此外,肿瘤复发样本中针对疫苗设计的新生抗原克隆显著减少,显示疫苗免疫对肿瘤微环境产生了选择压力,阻断了某些肿瘤克隆的复发,强调疫苗免疫的生物学影响。此项RNA疫苗采用的是不含修饰尿苷的mRNA-lipoplex纳米颗粒平台,能够有效传递编码个体化肿瘤新生抗原的mRNA至树突状细胞,启动强大抗肿瘤免疫反应。经过人工优化的新生抗原挑选与疫苗设计,不仅增强了免疫原性,更保障了疫苗的安全性和可制造性,推动了个性化免疫治疗的实用化。该研究的成果不仅在胰腺癌这一免疫耐受高且疗效匮乏的恶性肿瘤中取得突破,更为广泛癌症类型的疫苗开发提供了范式。通过针对肿瘤特征突变构建的个性化RNA疫苗,有望在多种实体瘤中诱导持续且多功能性CD8+ T细胞免疫,提高治疗成功率和长期生存。
研究团队目前正在进行全球范围的随机对照试验,持续评估这种RNA新生抗原疫苗的免疫疗效和安全性,旨在进一步验证其临床应用价值。综上所述,RNA新生抗原疫苗通过精准激活并长效维持CD8+ T细胞,开创了胰腺癌术后辅助治疗的新纪元,为攻克这一致死率极高的癌症提供了新武器。随着技术进步和积累更多临床数据,这种疫苗平台将极有可能在未来实现个体精准免疫治疗的广泛落地,改善众多癌症患者的预后和生活质量。