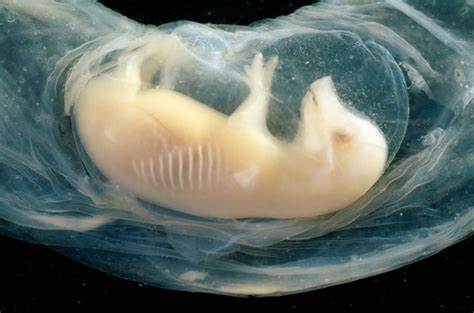
近年来,器官再生技术的快速发展为医学领域带来了前所未有的突破,尤其是胚胎干细胞和基因编辑技术的结合,极大地促进了跨物种器官移植研究。2025年6月,国际干细胞研究学会会议上公布的一项令人振奋的成果显示,科学家们成功在猪胚胎中培育出了含有部分人类细胞的微型心脏,且这些心脏能自主跳动,胚胎存活时间长达21天。这一突破不仅破解了人类器官供体短缺的难题,同时为治疗心脏疾病患者带来了新的希望。人体心脏作为维持生命的核心器官,其复杂性和生理功能的特殊性使得人工制造心脏极具挑战。传统的心脏移植面临捐献器官不足和排异反应等问题,使得大量患者处于等待名单上。科学家们一直寻求利用动物胚胎作为人类器官培养的“生物工厂”,而猪因其器官大小与人体相近,成为理想的研究对象。
然而,实现人类器官在猪体内的成功发育面临多种生物学和伦理学挑战。此次实验团队通过将人类的多能干细胞注射入猪胚胎,成功诱导这些细胞分化成心脏组织。在这21天的观察期中,人类细胞逐渐形成心肌结构,微型心脏开始有节律地收缩跳动,显示出初步的正常功能。这不仅验证了跨物种细胞融合和器官发育的可行性,更为未来更多类型器官的培育提供了实证基础。此次研究的成功还引发了关于人类与动物混合胚胎伦理问题的广泛讨论。在确保科学研究符合伦理规范的前提下,科学家们强调必须严格监管,确保不会出现人类意识或高级认知能力转移的风险。
此外,如何有效控制人类细胞在动物体内的比例与分布,是未来研究的重点方向,以避免潜在的生理和遗传安全隐患。尽管目前微型心脏的培育仍处于早期阶段,但这项技术为心脏疾病的根治提供了新思路。未来,当技术成熟后,利用患者自身细胞培育专属的心脏器官,将显著降低器官排异反应,提升移植成功率。同时,该技术还能推动个性化医疗的发展,实现精准治疗和再生医学的完美结合。此外,猪胚胎内人类器官培养为新药开发和疾病模型构建开辟了新路径。通过模拟人类心脏发育和疾病状态,科学家可以更准确地筛选药物,提高药物研发效率,降低临床试验风险。
这对于提升全球医疗水平和降低医疗成本具有重要意义。当前挑战还包括延长胚胎存活时间,促进器官进一步成熟及功能完善。科研团队正致力于优化培养环境,改进细胞注射技术以及基因编辑手段,以推动微型人类器官向临床应用迈进。此外,跨学科合作同样关键,生物医学工程、免疫学和伦理学专家共同参与,确保技术发展与社会价值的平衡。总结来看,微型人类心脏在猪胚胎中成功培育是生物医学领域的一次里程碑。它不仅突破了传统器官再生的瓶颈,亦为广大心脏病患者带来了康复的希望。
未来随着技术的不断完善和伦理规范的完善,有望实现更多种类的人类器官在动物体内生长,解决全球器官短缺困境,推动再生医学进入新的时代。科学的进步离不开社会的理解与支持,在关注科研突破的同时,也需全面审视其潜在风险与伦理底线,推动人类和动物共生健康发展的未来。