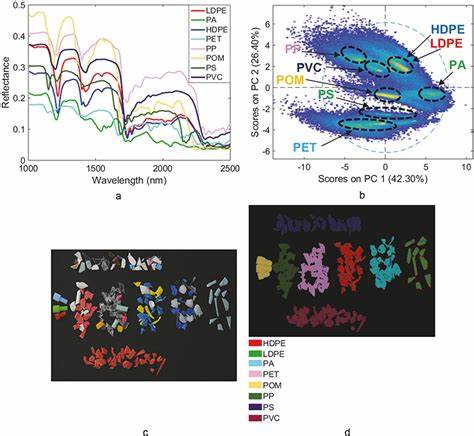
近年来,人工智能(AI)的快速发展正在深刻改变多个行业,医疗领域特别是药物研发也迎来了前所未有的革新浪潮。凭借强大的数据处理能力和模式识别技术,AI有望大幅加速新药的发现和验证过程,从而缩短药物从实验室到市场的周期,降低研发成本。然而,与这一变革并驾齐驱的,是监管机构特别是美国食品药品监督管理局(FDA)所面临的巨大压力和挑战。如何在保障药品安全和有效性的前提下,实现监管效率的提升,成为未来行业与政策制定者亟需解决的难题。 药物研发历来是一个耗时且资本密集的过程,传统的随机对照试验(RCT)往往需要数年甚至十年以上的时间才能完成,期间涉及大量临床试验和严苛的审评。AI技术在此背景下展现出巨大优势,通过分析海量生物医药数据、基因组信息以及临床试验结果,AI能够快速预测药物分子结构与靶点的相互作用,有效筛选潜在候选药物。
甚至可以在现有药物中发现新的适应症,实现所谓的"药物再利用",有助于节约恢复投入。同时,随着精准医疗理念的兴起,个体差异也被纳入治疗考量范围,AI能协助医生针对患者的遗传信息、病理特征和生活环境制定更为精准的治疗方案,推进与RATs时代不同的个性化医疗。 然而,正如经济学者亚历克斯·塔巴罗克(Alex Tabarrok)等专家指出,FDA现行的审批体系可能无法适应AI带来的研发速度和药物种类激增。审批困境可能导致审批积压,阻碍新药真正快速应用于临床,进而让创新红利难以惠及患者。若审批迟缓,部分创新企业甚至可能选择迁往监管更宽松的国家,以寻求更快捷的市场准入。中国等国家的药监机构近年来在审批流程和临床试验规范上不断优化,已成为重要的药物研发和商业化基地,这对美国FDA形成一定的竞争压力。
同时,AI对药物设计的推动也催生了对随机对照试验的重新思考。传统RCT的核心在于排除混杂因素,确保药物的安全性和有效性。但随着对人体生物学认知的深化和技术的进步,医学界开始意识到"平均效应"难以解释个体差异,尤其是在复杂疾病如癌症领域,疾病本身的异质性使得对所有患者一刀切的标准疗法存在局限。未来,通过AI辅助进行更精确的分层设计,临床试验有望变得更加高效和个性化,减少对大规模传统RCT的依赖。这一转变要求FDA和其他监管机构在法规层面作出适应,比如引入更灵活的审批标准和实时数据跟踪机制。 与此同时,值得注意的是,快速审批和AI驱动的药物研发也伴随着潜在风险。
未经充分测试和验证的新药可能导致意想不到的副作用和安全隐患,临床医生在面对全新药物时也缺乏足够的使用经验。因此,监管机构需要在加快审批的同时,加强后续监测和风险管理,确保患者权益不被忽视。迄今为止,美国、欧洲和亚洲均在探索创新监管模式,如合作审批、条件批准和基于真实世界证据的监管路径,旨在平衡创新活力与安全保障之间的关系。 AI还能在药物再利用领域发挥重要作用。许多已经上市的药物本身具备多种潜在治疗效果,医生可基于"非指定用途"开出处方,缩短病人接受新疗法的时间窗口。举例来说,COVID-19大流行期间,已被批准用于其他疾病的地塞米松迅速被证明对部分新冠患者有效,医师几乎在试验结果公布后立即开始使用,避免了额外审批带来的延误。
借助AI对大量药物和临床数据的深入分析,未来会有更多旧药获得新生命,造福更多患者。 围绕这一主题,业内也出现不同的声音。部分专家提醒,不应低估人体生物系统的复杂性,与机械修理不同,人体疾病往往涉及多重机制和动态调整,即使大数据和AI技术强大,仍无法做到"零试验"直接设计"完美药物"。此外,临床试验仍然是排除潜在混杂因素和安全评估的必要手段,对公共卫生极为关键,特别是在涉及大量人群的药物上市推广阶段更是不可或缺。基于此,未来FDA的改革或许更倾向于采取分阶段审批,结合AI预测和分子测序结果,实现药物研发与监管的有机融合。 从政策视角来看,面对AI技术带来的创新红利与挑战,FDA和其他全球监管机构需继续加强国际合作,借鉴中国、欧盟等地的经验,推动审批流程透明化和标准化,同时积极引导产业界建立伦理和安全框架。
此外,公众教育也十分重要,以避免医药使用过程中产生因政治或意识形态因素而引发的偏见,确保科学与监管主导医疗决策和药物应用。 总的来说,人工智能正在推动医药研发进入一个全新时代,其带来的药物发现速度加快、精准治疗个性化和药物再利用三大优势为人类健康福祉提供了前所未有的机遇。然而,FDA作为关键的监管机构,也面临着提升审批效率、适应新的科学方法以及有效管理风险的多重挑战。只有FDA与整个行业携手改革创新,建立更灵活且科学的监管框架,才能真正释放AI在医疗领域的巨大潜力,造福患者和社会。未来医药创新的蓝图,必将是技术与制度双轮驱动,共同筑造更加高效、安全和个性化的医疗新生态。 。