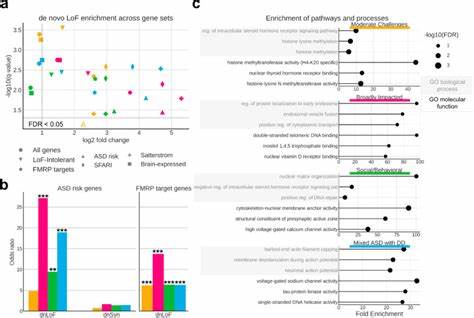
自闭症谱系障碍(ASD)是一类具有高度异质性的神经发育障碍,主要表现为社会交往障碍、语言沟通缺陷及刻板重复行为。随着诊断标准的拓宽及认知的提升,自闭症的临床表现呈现出前所未有的多样性,这种复杂的表型异质性对临床诊断、治疗策略的制定以及遗传学研究均构成了重大挑战。近期,基于大规模人群的深入表型与基因组测序数据,通过创新的混合模型分析,自闭症的异质性得以被细致拆解,揭示出背后隐藏的基因调控程序和发育阶段特异性基因表达模式,为理解自闭症的遗传架构开启了新的视角。自闭症的多维表型结构远超核心症状,伴随广泛的认知、行为、情绪障碍以及其他共病状况,这些特征在不同个体中表现不一,复杂的互相关联使得单一指标的遗传关联分析难以充分反映其真实生物学机制。因此,采用以个体为中心的综合表型模型能够捕捉多个表型间的联动和共同变化,有助于建立更具临床意义且具有遗传解释力的分类。基于SPARK人群数据库中5392名自闭症儿童的239项表型指标,研究团队利用基于生成模型的广义有限混合模型(GFMM)成功划分出四个稳健且具临床相关性的表型亚型,分别呈现出截然不同的社交行为障碍、重复行为、发育迟缓及共病水平。
这四个亚型不仅在核心自闭症症状表现上差异显著,且在注意缺陷、多动障碍、焦虑抑郁等协同症状的频率和程度上展现出独特的配置。更重要的是,在独立的Simons Simplex Collection(SSC)队列中,这一分类框架得到高度复制,进一步验证了其稳健性和普适性。对四个亚型的进一步遗传分析揭示了差异化的遗传负担和遗传路径。Broadly affected(广泛受累型)亚型表现出最高的高致病性脱氧核糖核酸变异(DNV)负担,主要集中在进化高度保守的基因和FMRP靶基因上,显示了严重智力障碍及发育迟缓的典型遗传背景。Social/behavioral(社交行为型)亚型则富集与常见变异相关的多基因风险,尤其是与注意缺陷多动障碍和抑郁症相关的多态性,同时该亚型的致病变异多聚焦于出生后表达的神经元特异性基因。而Mixed ASD with DD(混合发育迟缓型)亚型则遗传负担集中在同时具备高致病性脱氧核糖核酸变异和罕见遗传变异,影响主要是发育期表达的神经元基因,强调了严重发育迟缓与早期神经发育过程的联系。
Moderate challenges(中度挑战型)亚型则表现出较低的变异负担,突出了低约束力基因受影响的遗传特点。这些遗传负担的分布不仅反映出不同表型亚型的遗传架构差异,也暗示着基因功能和生物学通路的异质性。基因本体富集分析展示了各亚型变异影响的生物学过程高度差异。社交行为型集中于染色质重塑、DNA修复和微管相关机制,符合神经发育早期的基因调控异常。混合发育迟缓型则突出神经元动作电位和膜去极化相关基因,体现神经电生理功能的异常。中度挑战型与染色质修饰相关分子功能的富集则暗示了较为缓和的分子病理背景。
发育过程中的基因表达动态进一步揭示了各亚型背后的时间特异性遗传机制。社交行为型所涉及的基因多在出生后高表达,主要影响皮层抑制性中间神经元的成熟,反映出临床表现相对较晚出现且发展较缓慢的特征。相反,混合型发育迟缓亚型相关基因在胚胎及新生阶段表达高峰,涉及广泛神经元和胶质细胞种类,强调其早期神经发育的深度干扰。广泛受累型涵盖从胚胎到成年各发育阶段的基因,支持其复杂多维的临床表现。不同亚型间发育基因表达差异与临床里程碑(如首次行走或首次语言表达的年龄)高度一致,支持基因调控时间窗口与临床表现的紧密关联。多维表型和遗传结果相结合,研究提供了更强有力的亚型分子基础框架,为精准医学提供了有力支撑。
通过对自闭症多样且共病复杂群体进行系统分类,研究不仅提高了对其遗传异质性的理解,更为未来个性化诊疗指明方向。针对不同表型亚型设计的定制化干预措施有望提高临床疗效。在基因层面,揭示的不同发育阶段及细胞类型相关的基因调控网络,也为后续功能实验和新药靶点的发现奠定了基础。值得注意的是,尽管基于自报数据的表型收集存在一定局限,但通过与临床诊断数据和外部队列的高一致性验证,以及严谨的统计和遗传学分析,有效地缓解了潜在偏差的影响。随着队列规模的扩大和表型测量的细化,结合数字化表型和纵向跟踪研究,预计能够在未来进一步揭示罕见变异与常见变异的复杂互作及其对自闭症临床表现的贡献。此外,结合全基因组测序和表观遗传信息,未来的研究将更全面地刻画自闭症的遗传和分子机制。
总的来说,对自闭症表型异质性深度分解并结合大规模遗传数据的研究,开创了厘清复杂遗传背景与多样临床表现之间联系的新纪元。基于个体的综合表型模型使得隐含的临床亚型得以显现,并明确了对应的遗传痕迹及分子通路,为精准诊断、预测与治疗策略提供了科学依据。未来的研究依托持续扩展的样本量、技术进步和多模态数据融合,有望加速自闭症谱系障碍的生物学本质解码,推动精准医疗新时代的到来。