近日生物技术公司Cidara Therapeutics(纳斯达克代码CDTX)宣布将其长效单剂流感抗病毒候选药CD388的III期试验提前并扩大入组人群,此举不仅对公司研发节奏和股价形成推动,也在流感防治和应对大流行的长期策略上具有重要意义。本文将从科学机理、临床试验设计、监管路径、市场与商业化前景,以及潜在风险等多维度对CD388及Cidara的前景进行深入解读,帮助读者全面理解这一进展的内涵与可能影响。 Cidara的技术平台及CD388的作用机制是理解其潜力的起点。Cidara依托名为Cloudbreak的专有平台开发"药物-Fc偶联体"(Drug-Fc Conjugate,简称DFC)分子。DFC通过将药效成分与人源化Fc片段结合,赋予分子更长的体内半衰期和优化的分布特性,从而实现一次给药带来持久的抗病毒或抗肿瘤效应。CD388基于该平台设计,目标是以单次注射实现对季节性及潜在大流行性流感病毒的广泛预防,通过抑制病毒复制直接阻断感染,区别于传统疫苗依赖宿主产生免疫反应的路径。
长期作用、快速生效和覆盖更广泛人群的潜力,使得CD388在公共卫生和临床实用性上具有显著吸引力。 临床进展方面,Cidara在完成与美国食品药品监督管理局(FDA)的阶段性评估会谈后,决定将原计划的III期启动时间提前约六个月,并将试验规模和入组标准扩展。新的ANCHOR III期试验已在2025年9月开始给药,计划招募约6,000名参与者,目标人群覆盖65岁以上的老年人、高危人群以及12岁及以上免疫功能低下或其他高风险个体。此举旨在与秋冬流感季节更好地对齐,提高病例发生率以加速疗效信号的观察。FDA在会谈中暗示,对于某些生物制剂,如果III期试验设计合理并能充分证明有效性与安全性,单一成功的III期试验可能成为生物制剂许可申请(BLA)的核心依据,从而在监管路径上为CD388争取更明确的可行性。 此前的临床数据也是公司决策的重要支撑。
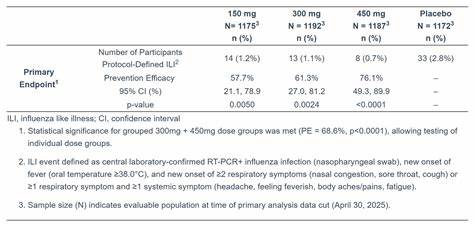
Cidara发布的IIb期NAVIGATE研究结果被市场解读为积极,显示CD388在安全性、耐受性和潜在疗效方面具备有利特征。尽管IIb期研究样本量与终点设定不同于III期,但其数据为扩大入组范围、优化剂量和预期真实世界效益提供了实证基础。此外,Cidara还披露了一系列有利的前临床数据,显示CD388在动物模型中对包括高致病性H5N1在内的多种流感亚型具有活性,这种广谱潜力在面对不可预测的变异株或未来大流行时尤为重要。 从公共卫生角度看,流感每年给全球带来巨大的疾病负担。传统疫苗在减轻严重疾病和死亡方面发挥重要作用,但其保护效果受病毒株选择、宿主免疫反应及时间等多因素影响,保护覆盖并非始终理想。季节性疫苗的匹配问题和免疫逃逸使得对额外工具的需求持续存在,尤其是对老年人和免疫功能低下者等疫苗应答较弱的人群。
单剂长效抗病毒药若能在临床实证中证明安全性与显著的预防效果,将成为补充或替代策略,为短期暴露后或流行高风险期提供直接保护。 商业潜力方面,Cidara此次扩大试验入组人群的决定突显其市场愿景。在美国,若将65岁以上人群、高危和免疫抑制者计入潜在使用人群,目标市场规模可能超过1亿人。考虑到流感的周期性和年度防护需求,一个一次性或少次给药即可覆盖整个流感季的产品在商业化上具有吸引力。公司不仅可在老年护理、住院前预防和特定职业高暴露群体中寻求市场切入,还能探索在疫情爆发时作为应急储备用药的潜在需求。 监管与研发风险同样值得关注。
虽然FDA暗示单一成功III期试验可能足以支撑BLA,但实际批准还将取决于试验设计是否能充分证明在真实世界人群中的临床获益,以及长期安全性数据是否令人满意。特别是对于众多可能合并用药、存在慢性疾病或免疫抑制的高风险人群,安全性监控需更加严谨。另一个潜在挑战是制造和质量控制的放大效应。长效生物制剂通常在生产工艺、纯化和稳定性方面有更高要求,若商业化后需快速扩大产能,相关合规与供应链问题不可忽视。 竞争格局方面,CD388并非孤军作战。当前市场上存在口服小分子抗流感药如奥司他韦(oseltamivir)和新型药物如baloxavir等,主要用于治疗或暴露后预防,但大多数需要短期重复给药且对某些病毒株敏感性不同。
与此同时,长期关注的"普适性"流感疫苗研发也在推进,若未来出现可广泛覆盖多株的单剂疫苗,将直接挑战长效抗病毒药的市场定位。此外,其他生物制剂和单克隆抗体也在开发中,部分方案同样寻求通过长效设计提供被动免疫或病毒直接中和的保护。CD388的竞争优势在于其基于DFC的独特分子工程和初步显示的广谱抑制能力,但最终能否在监管、临床与商业多方面同时取得领先仍需观察。 投资者角度应关注的关键节点包括试验开展进度与中期安全性数据公布、III期最终临床终点达成情况、监管沟通细节、生产放大与成本结构,以及公司在其他候选药物上的进展。市场对消息高度敏感,Cidara在宣布试验提前后股价出现显著上涨,分析师也据此上调了部分价格目标,最高曾达到167美元的预测。然而早期积极的股价反应并不能替代临床和监管的实质性证据,对长期投资价值和风险敞口仍需理性评估。
除了CD388,Cidara在研发管线的多样化也值得注意。公司正在推进其他DFC项目,涉及肿瘤免疫等领域,如针对CD73的CBO421已获得临床试验授权(IND清关),并进入肿瘤相关的早期开发阶段。这类肿瘤免疫项目不仅为公司提供了潜在的长期商业增长点,也在技术平台层面验证了Cloudbreak的可扩展性。如果多个适应症的候选药物能成功进入临床并展现活性,平台许可或合作开发的商业化路径将可能带来额外价值。 从公共卫生与社会影响角度,若CD388最终获批并能够实现单剂长期预防,可能改变流感防控的战略布局。其可被用于长期居住社区、长期护理机构和资源受限地区的季节性预防,也能在疫情早期作为迅速部署的防护手段。
此外,单剂预防策略在提高患者依从性、降低医疗资源消耗和简化公共卫生计划方面具有明显优势。不过,药物定价、医保覆盖与公平分配问题将成为实际应用中的重要考量,需要政策层面与制造商共同协作以确保高风险人群的可及性。 科学界与临床界对CD388的关注不仅基于其单剂设计,更来源于其对不同流感亚型潜在的广谱抑制能力。流感病毒不断变异,尤其是在动物宿主与跨种传播过程中出现的新亚型(如H5N1)对公共卫生构成威胁。具有广谱抗病毒活性的单剂产品若能证明跨亚型保护,将成为抗击未来可能出现的新一轮大流行的重要工具。当然,广谱性也需通过多个流行季节和多种流行株的临床验证才能被广泛接受。
在预期时间表上,III期ANCHOR试验的加速启动意味着若试验在首个覆盖季节内能累积足够事件并显示显著疗效,Cidara可能在随后一年内获取关键性数据并与监管沟通。然而,流感季节的变数、病例发生率的不确定性以及数据监测委员会的审慎评估都会影响最终时间线。因此,虽有加速的积极信号,但对结果的时间性与可预见性仍需保持审慎态度。 总结来看,Cidara将CD388的III期试验提前并扩围是一项兼具临床意义与商业野心的战略动作。CD388基于Cloudbreak平台的DFC技术展现出单剂长效、广谱抑制的潜力,若在ANCHOR III期试验中得到强有力的证据支持,既能为流感防控带来新工具,也可能为公司带来重要的商业回报。然而监管要求、长期安全性、制造放大及市场竞争等因素同样构成不容忽视的风险。
对于关注这一项目的临床研究者、公共卫生决策者与投资者来说,接下来数月到数年内的临床数据披露、监管互动与公司在生产与商业化上的部署,将是判断CD388能否真正实现其前景的关键。无论结局如何,Cidara在这一进程中对长效抗病毒策略的探索都为流感防治领域提供了新的视角与可能性,值得持续关注。 。