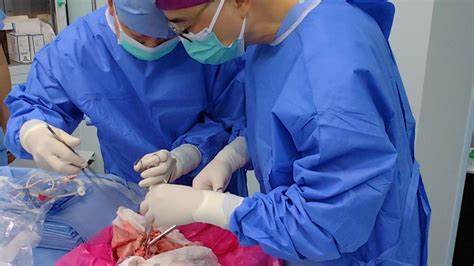
近年来, 器官移植始终是医学领域的热门话题, 尤其是在供体短缺问题日益严峻的背景下, 如何拓展器官来源成为关键。猪作为与人类生理结构较为相似的物种, 长期以来被视为异种移植的潜在器官提供者。而近日, 中国科学家在全球首次完成基因编辑猪肺移植到一位脑死亡患者体内的实验, 并成功使该肺维持活性长达九天, 引发了国内外医学界的广泛关注。此次跨越物种的肺脏移植不仅是异种器官移植领域的重要里程碑, 也为器官移植临床实践带来了崭新视角和希望。该实验由广州医科大学附属第一医院团队主导, 研究成果发表在国际顶尖医学期刊《自然医学》上。患者是一名39岁的男性, 在完全脑死亡状态下接受了这一挑战性的移植手术。
医生事先确认患者脑死亡状态并获得家属书面同意, 体现了严谨的伦理规范与科学精神。移植过程中, 为降低免疫排斥反应, 团队采用了CRISPR基因编辑技术对猪肺进行改造, 关闭了三种关键的基因, 防止猪器官表面特定蛋白激活人体免疫系统。此外, 他们还分别引入三种人类基因, 旨在使猪肺更容易被人体接受。这种双向基因调控策略体现了基因科技在器官移植中的创新应用价值。手术于2024年5月完成, 外科医生移除了猪的左肺并植入患者体内, 同时患者保持原有的右肺功能。为了控制免疫反应, 患者在术前一天开始接受免疫抑制药物治疗, 后续每日继续给予相应剂量。
移植成功避免了立即出现的"超急性排斥反应",这是一种极为猛烈的免疫攻击, 往往导致异种器官瞬间失效。然而, 实验也揭示了肺脏特殊的生理结构与功能对移植的巨大挑战。肺脏作为人体内直接与空气接触的器官, 其组织含有大量免疫防御蛋白, 这使其在异种移植中成为免疫攻击的易感目标。约术后24小时, 肺脏开始出现肿胀和炎症迹象, 病理反应显示免疫系统渐渐识别出异体组织, 产生针对肺脏的抗体。尽管如此, 肺脏仍维持了基本的生理功能和活力, 直到实验结束9天时因损伤累积而被终止。相关研究人员认为, 后续可通过靶向抑制特定的免疫细胞或炎症信号通路, 进一步延缓或控制肺脏的排斥反应。
肺异种移植的复杂性不仅来自免疫反应, 也源于肺组织高度娇嫩, 关键的气体交换功能一旦受损, 可能导致严重后果。此次实验通过展示基因编辑猪肺能够在人体内短暂存活且维持功能, 成为未来活人移植试验的重要基石。专家指出, 虽然此次研究尚未达到临床推广条件, 但它突破了多个传统难题, 例如异种器官与人体免疫系统的初步相容性验证, 以及通过基因工程减少排斥反应的实践可能。实验也明确表明, 动物模型无法完全反映人体实际反应, 因此在脑死亡人体受体中进行此类实验尤为重要。此外, 该试验突显伦理考量在科学前沿探索中的核心地位。患者家属的知情同意与多重脑死亡评估, 保证了科学研究的社会认可和合法合规, 为后续类似研究树立了良好范例。
在全球范围内, 异种器官移植正在稳步推进。美国、欧洲等地已经进行了包括肾脏和心脏等猪器官的移植实验, 但肺脏因其独特的免疫微环境和生理特性, 一直被视为极具挑战的目标。此次中国科学家的突破性工作无疑为行业注入了信心和动力。未来, 进一步完善基因编辑技术、创新免疫调控方案将是关键。包括精准免疫抑制、免疫耐受诱导以及组织工程的结合, 可能使异种肺移植实现真正临床应用。对于患者等待器官移植的庞大群体而言, 异种器官移植若能成熟, 将极大缓解全球供体短缺的困境, 拯救更多生命。
与此同时, 研究人员也在积极探索如何确保移植器官的长期稳定性和功能完整性, 同时避免潜在的病毒传染风险和其他安全问题。综合来看, 猪肺异种移植实验标志着器官移植领域向前迈出了一大步, 代表了基因科技、免疫学和外科技术的深度融合。虽然离常规临床应用仍有距离, 但这项创新尝试已揭示出开放的未来可能。更多研究与临床试验的推进, 有望为器官短缺的难题提供创新解决方案。总之, 猪肺移植人体实验的成功不仅是科学技术的胜利, 也是人类对生命健康不懈探索的象征。随着相关技术的不断提升和伦理框架的完善, 异种器官移植有望成为未来移植医学的重要组成部分, 改写器官移植领域的历史。
公众理解和支持这类前沿科学研究, 将为医疗进步注入持续动力, 助力实现器官移植新时代的梦想。 。