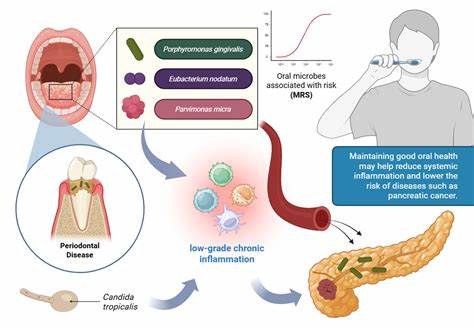
近年来,口腔微生物组不再被视为仅限于龋齿和牙周疾病的局部问题。越来越多的研究表明,口腔内的细菌与真菌群落可能通过多种路径影响全身健康,甚至与某些恶性肿瘤的发生有关。2025年发表在权威期刊的一项大型前瞻队列研究提供了新的证据,显示口腔细菌与真菌的组成在统计学上与后续胰腺癌风险有关,这一发现引发了对口腔微生物作为早期风险筛查标志物以及预防干预潜力的广泛关注。 该研究利用两个大型队列共约12.2万名提供口腔样本的参与者数据,研究者通过全基因组宏基因组测序鉴定细菌谱系,并用ITS测序解析真菌群落。研究在随访中发现445例胰腺癌患者,并将其与445名匹配的对照进行比较,匹配变量包括年龄、性别、种族与样本采集时间等。研究在时间窗上设置了滞后期,并在多种敏感性分析中检验了结果的稳健性。
主要发现包括若干已知的牙周致病菌,如Porphyromonas gingivalis、Eubacterium nodatum与Parvimonas micra,与胰腺癌风险呈正相关;另有多种细菌表现出风险升高或降低的关联;在真菌方面,Candida属与胰腺癌风险的增加相关。研究者基于27种与风险相关的微生物物种构建了微生物风险评分,发现每单位标准差上升与胰腺癌风险显著相关,提示口腔微生物组合可能具有较强的标志物价值。尽管这些结果令人警醒,但必须强调统计关联并不等同于因果关系,研究作者也在文章中讨论了方法学限制并呼吁进一步验证。 从生物学上讲,口腔微生物影响胰腺癌的可行机制具有多重合理性。慢性牙周炎和牙周致病菌可引起局部和系统性慢性炎症,炎症介质进入循环后可能在远端器官诱导免疫微环境改变与促癌信号通路活化。某些牙周致病菌能够产生外毒素、内毒素或蛋白酶,破坏上皮屏障并促发促炎细胞因子的释放,使得细菌或其产物有机会经血液或淋巴转移到远端器官。
另一个重要路径是微生物与宿主免疫的直接相互作用,例如某些口腔细菌可激活TLR信号通路并改变宿主的抗肿瘤免疫反应。此外,口腔真菌与细菌之间存在复杂的协同或拮抗关系,真菌群落的失衡可能放大炎症反应或改变微生态稳定性,从而间接影响致癌过程。 研究还提出了口腔微生物作为非侵入性生物标志物的潜力。口腔采样便捷且可在常规牙科检查时收集,如果微生物组合在不同人群中被证实稳定并能预测未来胰腺癌发生,便可能用于早期风险分层。基于微生物风险评分的筛查工具,有望帮助将有限的高成本影像学检查与高风险人群更精准地匹配,从而提高早期发现率并降低不必要的检查负担。然而,从研究到临床转化仍面临若干挑战,包括生物标志物的外部验证、不同种群间的可重复性、模型的校准与决策阈值设定以及如何将微生物信息与传统风险因子(如年龄、吸烟、糖尿病、家族史)整合以优化预测性能。
不可忽视的是方法学与解释上的局限。第一,研究主要基于单次基线口腔样本,个体口腔微生物随时间存在波动,单次测定可能未能完全代表长期暴露状态。第二,真菌分类学分辨率受限,ITS短序列有时无法准确鉴定至种甚至株水平,这可能导致对于某些真菌信号的误判或掩盖。第三,逆向因果关系的可能性必须谨慎对待。尽管研究在分析中采用了多种滞后和敏感性检验,胃肠道或胰腺的病理改变在临床症状出现前多年可能已影响宿主微生态,从而使口腔菌群的变化既可能是病因也可能是早期病变的表现。第四,混杂因素控制永远是流行病学研究的核心挑战,生活方式、社会经济地位、药物暴露(例如近期使用抗生素或抗真菌药)、口腔卫生行为与牙周疾病史都可能混杂微生物-癌症关联,需要更细颗粒度的数据来校正。
面向公众与临床实践,该研究强调了口腔健康的重要性,但并不意味着单纯依靠特定口腔抗菌措施即可预防胰腺癌。保持良好的口腔卫生仍是降低牙周疾病与可能相关系统性风险的现实可行策略。建议常规刷牙、使用牙线、定期牙科检查与专业洁牙,尤其是有糖尿病、吸烟史或家族肿瘤史等高危人群,应更重视牙周保健。此外,戒烟、健康饮食、体重管理与糖代谢控制等生活方式调整也有助于整体癌症风险的降低。对于含氯己定等抗菌漱口水的长期使用应在牙医指导下进行,因为长期广谱杀菌可能扰乱微生态平衡并带来其他副作用。 在科研层面,未来研究需要在多个维度推进验证与机制探索。
首先是外部队列验证,尤其是不同种族、地理与社会经济背景的人群,验证微生物风险评分的可迁移性和预测价值。其次是纵向多时点采样研究,以评估口腔微生物随时间的稳定性和变化与胰腺癌发病之间的时间序列关系。第三是多组学整合研究,将口腔微生物组与血液循环中的微生物游离DNA、宿主基因表达、代谢组和免疫表型结合,以构建从暴露到致病的证据链。第四,需要更精细的微生物学工作,包括长读长测序、培养学验证和菌株水平的溯源,以判断口腔微生物是否能转移并在胰腺组织中存活并发挥致病作用。最后,干预试验将是判断因果关系与评估预防策略效果的关键,例如针对牙周炎的规范治疗是否能在长期随访中降低胰腺癌或其他系统性疾病的发生率。 对普通读者而言,理解研究带来的启示与局限同样重要。
现有证据支持将口腔健康视为全身健康的重要组成部分,但无需因单项研究而过度担忧或采取极端措施。与其关注单一微生物是否致癌,不如采取稳妥的口腔保健与生活方式管理:定期口腔检查、规范刷牙和牙线使用、戒烟限酒、均衡饮食与管理慢性疾病。若个人有严重牙周病或不明原因的持续口腔不适,应及时就诊,牙医和全科医生可以共同评估并提出个性化建议。 政策制定者与公共卫生机构也可从中汲取策略方向。若后续研究继续支持口腔微生物作为疾病风险筛查的潜在工具,公共卫生体系可在预防优先级、基层牙科服务覆盖与口腔健康教育方面投入更多资源。此外,将口腔健康纳入慢性病管理与癌症防控的综合策略中,可能带来成本-效益上的协同效应,尤其在烟草使用和糖尿病等已知共同危险因素的管理上。
总之,口腔微生物组与胰腺癌风险的关联为我们提供了新的视角,提示口腔生态与全身健康之间关系的复杂性与重要性。现有大规模前瞻性证据增强了该领域的可信度,但要把这种关联转化为可行的临床筛查或有效的预防干预,还需要更多严谨的验证、机制研究与随机对照试验。与此同时,维持良好口腔卫生、管理已知的生活方式风险因素以及与医疗专业人员保持沟通,仍是个人减少综合健康风险的现实且可靠的做法。未来随着测序技术、微生物学方法与多组学整合的进步,口腔微生物有望成为肿瘤预防与早筛领域的重要补充,但在那之前科学界需稳步推进证据积累与临床转化的路径。 。